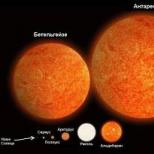
Ce înseamnă chimic. Simboluri ale elementelor chimice și principiile denumirii lor. Alte moduri de a numi
Dicţionar Ushakov
Chimie
chi mia, chimie, pl. Nu, Femeie (greacă chimie). Știința compoziției, structurii, modificărilor și transformărilor, precum și a formării de noi substanțe simple și complexe. Chimia, spune Engels, poate fi numită știința modificărilor calitative ale corpurilor care apar sub influența modificărilor compoziției cantitative. Chimie organica. Chimie anorganică. Chimie aplicată. Chimie teoretică. Curs de chimie.
| ce. proprietățile chimice ale ceva științific). Chimia uleiului.
Dicţionar enciclopedic
Chimie
(posibil din grecescul Chemia - Chemia, unul dintre nume antice Egipt), o știință care studiază transformarea substanțelor, însoțită de o modificare a compoziției și (sau) structurii acestora. Procesele chimice (obținerea metalelor din minereuri, vopsirea țesăturilor, îmbrăcarea pielii etc.) au fost folosite de omenire deja în zorii vieții sale culturale. În secolele 3-4. s-a născut alchimia, a cărei sarcină era să transforme metalele comune în metale nobile. Încă din Renaștere, cercetarea chimică a fost folosită din ce în ce mai mult în scopuri practice (metalurgie, sticlă, ceramică, vopsele); exista şi o direcţie medicală specială de alchimie – iatrochimie. La etajul 2. secolul al 17-lea R. Boyle a dat primul definiție științifică concepte "element chimic". Perioada de transformare a chimiei într-o adevărată știință s-a încheiat în a doua jumătate. al XVIII-lea, când a fost formulată legea conservării masei în reacțiile chimice (vezi și M. V. Lomonosov, A. Lavoisier). La început. secolul al 19-lea J. Dalton a pus bazele atomisticii chimice, A. Avogardo a introdus conceptul "moleculă". Aceste concepte atomice și moleculare au fost stabilite abia în anii 1960. secolul al 19-lea În același timp, A. M. Butlerov a creat teoria structurii compușilor chimici, iar D. I. Mendeleev a descoperit legea periodică (vezi Sistemul periodic al elementelor lui Mendeleev). Din con. 19 - cers. Secolului 20 cel mai important domeniu al chimiei a fost studiul legilor proceselor chimice. În chimia modernă, domeniile sale individuale - Chimie anorganică, chimia organică, chimia fizică, chimia analitică, chimia polimerilor au devenit în mare măsură științe independente. La intersecția dintre chimie și alte domenii de cunoaștere, de exemplu, au apărut biochimia, agrochimia și geochimia. Asemenea științe tehnice precum tehnologia chimică și metalurgia se bazează pe legile chimiei.
Dicționarul lui Ozhegov
X ȘI MIA,Și, și.
1. Știința compoziției, structurii, proprietăților substanțelor și transformărilor lor. anorganic x. x organic. x fizic. (bazat pe principii generale fizică).
2. ce. Compoziția în sine, proprietățile substanțelor și transformările lor. H. glucide. H. ulei.
3. colectate chimicale. Gospodărie x.
4. Un mod de a influența pe cineva. cu ajutorul chimicalelor (colocviale). Faceți chimie (perm folosind astfel de mijloace). Faceți un curs de chimie (adică un curs de tratament cu astfel de agenți, chimioterapie). Aterizări tratate cu chimie (produse chimice).
| adj. chimic, o, o.
Dicţionar al lui Efremova
Chimie
- și.
- :
- disciplina stiintifica studierea substanţelor, compoziţia, structura, proprietăţile şi transformările lor reciproce.
- O materie academică care conține fundamentele teoretice ale acestei științe.
- se desfășoară Un manual care stabilește conținutul unei anumite discipline academice.
- Aplicarea practică a acestei științe și a legilor ei în producție, industrie etc.
- Compoziția calitativă a smth.
- se desfășoară Preparate, substanțe chimice, soluții etc utilizate în producție și viața de zi cu zi.
- se desfășoară Produse alimentare care nu conțin aproape niciun ingrediente naturale.
- trans. se desfășoară Permanent.
- :
Enciclopedia lui Brockhaus și Efron
Chimie
Sensul original și originea acestui cuvânt sunt necunoscute; este posibil să fie pur și simplu un nume vechi pentru nordul Egiptului, iar atunci știința chimică înseamnă știință egipteană; dar din moment ce Chemi, pe lângă Egipt, desemna și negru, iar μελάνοσις (înnegrirea) era considerată o operație inevitabilă în transformările metalelor, se poate ca τέχνη τής χημείας - Olympiodorus, să fie arta de a prepara această substanță de înnegrire (cf. H. Kopp , „Geschichte der Chemie”, II, 1844, 4 - 6, și M. Berthelot, „Introduction a l” é tude de la chimie des anciens et du moyen вge ", 1889). „Din majoritatea celorlalte științe. X. în dezvoltarea sa se distinge prin faptul că scopul său a fost înțeles diferit în diferite momente... În timp ce în alte domenii de activitate spirituală, indiferent de atitudinea față de ele în alte perioade, scopul a fost întotdeauna clar recunoscut și a fost constant. adică în istoria lui X. acest lucru nu se observă deloc. Această știință schimbă nu numai alegerea mijloacelor și aplicațiilor auxiliare, ci și întreaga sarcină și condițiile de existență a acesteia (cf. Alchimie, Iatrochimiști, Phlogiston)... În prezent, - continuă G. Kopp (" Geschichte der Chemie", I , 1843, 5), sarcina lui X., luată de la sine (an und f ü r sich), este descompunerea compușilor în părțile lor constitutive și formarea din nou a compușilor din părțile constitutive [ Această definiție datează de la mijlocul secolului al XVII-lea, când Lemery, în Cours de Chymie, spune că „La Chymie est un art, qui enseigne a sé parer les différentes substances qui se rencontrent dans un mixte” (Corr. „Geschich ." II, 8), un Oțel a adăugat la aceasta „și arta reamestecării părților constitutive” (Corr, l.c.). Conceptul de părți constitutive ale amestecurilor s-a schimbat; contemporanul a fost deja conturat de Boyle, dar a fost în general acceptat abia după Lavoisier (vezi Lavoisier și Phlogiston).]. Sarcina, deci, este de a cunoaște compoziția tuturor corpurilor și cu exactitate cum se formează și cum se pot forma.istoria naturală, al cărei subiect cel mai apropiat este „studiul substanțelor omogene, din a cărui adăugare toate corpurile. ale lumii sunt compuse, transformările lor și fenomenele care însoțesc astfel de transformări.” Potrivit lui Ostwald (W. Ostwald, „Grundlinien der anorg. Ch.”, 1900, 1), „aceste transformări pot fi împărțite în două mari, nu tocmai grupuri strict izolate. Uneori transformările privesc doar una, sau câteva relații și proprietăți ale corpului studiat; uneori sunt de așa natură încât corpul studiat dispare ca atare, iar în locul lui apar corpuri noi cu proprietăți noi. Fenomenele de primul fel sunt incluse în domeniul fizicii, al doilea - în domeniul lui X. ", iar, de exemplu, Ostwald ia în considerare raportul dintre sulf și șocurile mecanice (poziția relativă a corpului se modifică, dar nu nu se schimbă: culoarea, greutatea etc., așa-numitele proprietăți fizice ale acesteia), la încălzire slabă (se schimbă - temperatura, greutatea și volumul specific, presiunea vaporilor, alte (?) proprietăți rămân neschimbate), la electrizare și constată că fenomenele de acest fel ar trebui considerate fizice. Dar „dacă aduci (l. s., 2) o bucată de sulf în contact cu focul, ia foc și arde cu o flacără albastră. În același timp, se simte binecunoscutul miros de sulf ars, iar după ce arderea durează de ceva vreme, sulful, ca atare, dispare: s-a ars. În acest proces, nu numai proprietățile individuale ale sulfului se schimbă, dar... în loc de acesta, s-a format altceva; putem judeca acest lucru după mirosul care a apărut concomitent cu debutul fenomenului, dar nu a fost sesizat înainte. În acest caz, sulful a participat la procesul chimic ... Știința lui X are sarcina de a stabili legile tuturor acestor transformări. „În alte manuale, transformările fizice sunt definite ca acelea în care proprietățile materiei rămân neschimbate, restabilind în același timp starea sa inițială; în timpul procesului este imposibil, în plus, să se împartă o anumită parte omogenă a unui sistem de transformare în părți eterogene prin orice mijloace mecanice, cel puțin dacă pornim de la un corp omogen fizic; procese fizice, deoarece atunci când temperatura (și presiunea) inițială este restabilită, gheața se dovedește a fi în aceeași cantitate cu toate proprietățile fizice inerente în condiții date și, deși la punctul de topire al gheții putem avea substanța apei simultan în trei stări. - solid (gheață), lichid (apă) și gazos (abur) și le putem separa mecanic (gheața poate fi, de exemplu, filtrată din apa lichidă), dar nici gheața, nici apa, nici aburul nu pot fi împărțite în continuare fizic în substante eterogene prin orice metode mecanice cunoscute de noi . Dacă, totuși, gheața este evaporată și vaporii rezultați sunt încălziți la o temperatură de 1500 ° - 2000 °, atunci printr-un proces mecanic (folosind difuzie, vezi Disocierea) este posibil să izolați din masa vaporilor supraîncălziți un gaz care diferă de ele prin proprietăți (un amestec de hidrogen și oxigen). Prin răcire, apa singură se va transforma în gheață, iar corpul gazos, colectat separat și răcit rapid, își va păstra natura gazoasă; va fi deci un exemplu de transformare chimică a gheţii. În ciuda faptului că este ușor să găsești mai multe astfel de exemple în manuale și în ciuda faptului că împărțirea transformărilor materiei în cele fizice și chimice a fost consacrată de timp, este, fără îndoială, brusc unilateral și, prin urmare, incorectă. Ostwald greșește, fie și numai pentru că în exemplul său compară transformări complet incomparabile. Modificările în proprietățile sulfului care apar în el atunci când „energia de poziție” sa este schimbată pot fi lăsate deoparte; teoretic sunt necesare, dar în orice caz sunt atât de neînsemnate încât sunt evazive nu numai cu ajutorul simțurilor noastre, ci și cu ajutorul simțurilor rafinate de cele mai sensibile instrumente moderne. Când încălzim slab sulful, avem de-a face cu următoarele fenomene. Sistemul studiat, pe care Ostwald îl numește sulf, ar trebui considerat compus din doi termeni independenți (vezi Regula fazei): din sulf și oxigen atmosferic [Azotul și toți ceilalți constituenți gazoși ai acestuia iau o parte prea neglijabilă în transformare, cu excepția poate umiditatea - vezi Fenomene de contact - și de aceea prezența lor poate fi ignorată]; este în astfel de condiții de temperatură (suprarăcită), când, din cauza rezistențelor pasive, interacțiunea dintre aceste corpuri este aproape imposibilă sau, dacă se întâmplă, atunci la o viteză atât de nesemnificativă, aproape de zero, încât să fim complet incapabili să o facem. prinde-l. Putem, așadar, să considerăm întregul sistem în agregat ca fiind într-o stare de fals echilibru (fals echilibru) a lui Duhem, altfel instabil (cf. A. Gorbov, „Legea fazelor”, în „Anuarul fizico-matematic” , II), capabilă cu o mică modificare a condițiilor de echilibru până la transformarea completă; sulf, considerat separat, adică - neglijând reacția sa infinit lentă cu oxigenul, putem considera un sistem monovariant de un termen (sulf solid + abur în prezența a doi factori externi de echilibru: temperatura și presiunea), și se știe că legile la care este supus un astfel de sistem (vezi Regula fazei, l.c.) nu sunt diferite de legile la care este supus orice sistem monovariant cu orice număr de termeni independenți, sistemul de combinare a CaO + CO 2 (sau disocierea CaCO 3), de exemplu.; V simțul mecanic sulful solid cu vaporii săi formează un sistem indiferent de stabil. Dar haideți să încălzim sulful + oxigenul până la 500° aproximativ; imediat, interacțiunea lor începe de-a lungul suprafeței de contact, însoțită de apariția luminii și a căldurii (sistemul a fost suprarăcit): sulful, așa cum se spune de obicei, arde, dar oxigenul arde în mod egal, întâlnindu-se cu vaporii de sulf; pentru ambii termeni, măsura stabilității la contactul reciproc a fost depășită prin încălzire, iar sistemul a devenit instabil și este evident că este ilegal să adunăm starea indiferent de stabilă a sulfului cu starea instabilă a propriei + oxigen; și în timp ce sulful a rămas într-o stare indiferent de stabilă, atunci, repetăm încă o dată, modificările fizice ale proprietăților sale au respectat aceeași lege ca și transformarea „chimică” în sistemul CaO + CO 2 . Cu o foarte ușoară modificare, ceea ce s-a spus este aplicabil și sistemului de încălzire: gheață, apă lichidă și vapori ei. Atâta timp cât gheața și apa lichidă sunt încălzite singure, până atunci, pentru un anumit volum al sistemului, este posibilă (la un întreg interval de temperaturi și presiuni) coexistența a două faze: gheață + abur, gheață + apă lichidă. , apă lichidă + abur; toate aceste sisteme sunt monovariante și, ca atare, nu diferă în niciun fel de creta de disociere, de triclorura de iod formată (de disociere) (vezi Regula fazei, l.c.), adică de sistemele pentru care se presupune de obicei că apar în transformări. dintre ele nu sunt de natură fizică, ci chimică. Dar am supraîncălzit vaporii de apă printr-o tehnică specială (difuzia) [În acest fel se introduce un nou factor în condițiile de echilibru ale sistemului, și anume tensiunea capilară, și este foarte posibil ca aceasta să schimbe natura echilibru (cf. nota următoare).] am reușit să separăm o parte dintr-un astfel de sistem și noi presupunem că masa de abur rămasă, neseparată, diferă în proprietăți fizice față de partea separată, că diferă de aburul obișnuit doar într-un conținut diferit de energie mai mare; dar, evident, aceasta este doar o presupunere, deși poate cea mai simplă și mai probabilă; în ceea ce privește „amestecul exploziv” suprarăcit, acesta nu poate fi comparat cu apa, deoarece o astfel de comparație ar fi la fel de nefericită ca și apa suprarăcită cu gheața de aceeași temperatură; un sistem (apa suprarăcită) este instabil, cu rezistențe pasive (după Gibbs), celălalt este indiferent de stabil, cel puțin în prezența a doi factori externi de echilibru: temperatură și presiune [Vom construi o baterie cu gaz Grove din hidrogen, oxigen și apă, adică vom introduce mai mulți factori suplimentari de echilibru în el și va deveni echilibru, iar transformările sale vor fi reversibile chiar și la temperatura obișnuită.]. Rezumând cele precedente, ajungem la concluzia că definițiile obișnuite ale lui X. sunt oarecum înguste, iar cea mai generală este: X. este o știință exactă a istoriei naturale care studiază legile schimbărilor în starea materiei [Acest lucru nu prejudecă problema unității sau complexității acestei chestiuni.] ; îi clasifică în jurul compușilor „chimici”, iar aceștia din urmă – în jurul unor varietăți speciale, stabile de materie, numite „elemente” (pentru sensul expresiilor „compus chimic” și „element” – vezi mai jos legea constanței compoziției) . Este posibil, în acest studiu, să numim schimbări reversibile în starea materiei fizice și să le distingem de acele transformări „chimice” care în condițiile noastre sunt ireversibile și au loc unilateral, dar trebuie să ne amintim că până de curând și între acestea. transformări, o parte este recunoscută ca fiind fizică, cum ar fi, de exemplu, tranziția lichidelor suprarăcite la o stare solidă, cristalizarea soluțiilor suprasaturate [Dacă astfel de soluții sunt considerate nu din punctul de vedere al concentrației de termeni independenți, ci din punctul de vedere al influenței temperaturii asupra lor, ca factor de echilibru extern, atunci ar trebui recunoscute și ca sisteme suprarăcite.], deși nu sunt nimic nu diferă de fenomenele „chimice”, care sunt: explozia de peroxid de hidrogen lichid, ozon lichid, un amestec exploziv (hidrogen cu oxigen, clor cu hidrogen [Observațiile au arătat că amestecul de oxigen cu hidrogen este afectat și de lumină, care accelerează transformarea.]), etc. e. Din cele de mai sus din punct de vedere, este clar că informațiile raportate de obicei în chimie sunt unilaterale și fragmentare și că la acestea trebuie atașate numeroase date, de obicei incluse în cursurile de fizică, cursurile de cristalografie etc. etc., și care sunt doar cele mai multe În ultima vreme incluse în așa-numitele manuale. Chimie Fizica. Evoluția planificată a început relativ recent și este imposibil de prevăzut volumul lui X. chiar și în viitorul apropiat, dar într-o anumită măsură Mach are dreptate când spune că „în timpuri moderne au fost descoperite multe relații între fizică și X. Vechea idee că X poate fi privit ca fizică aplicată, în special mecanică aplicată, a primit o nouă încurajare în acest sens... În absența unei viziuni preconcepute, pare destul de probabil ca X . viitorului va îmbrățișa fizica , și nu invers” („Prinzipien der Wärmelehre”, 1900, 5, 354); nu există nicio îndoială că ambele științe vor beneficia de omogenitate dacă vor fi transferate de la fizică la X. toate acele departamente. în care se studiază modificările stării materiei, în funcție de modificările aprovizionării sale cu energie.
Legi și ipoteze X. Legile de bază ale lui X. pot fi împărțite în general calitativ și general cantitativ. legi de calitate.
I. Între ele ar trebui să fie plasate în prim-plan legea fazelor Gibbs; s-a afirmat deja mai devreme (vezi Regula fazelor, l.c.) și aici ne putem limita la a indica faptul că cel mai expresie generală este:
v = n + e - r,
Unde v- numărul de variaţii independente ale factorilor externi şi interni ai echilibrului sistemului sau numărul gradelor sale de libertate; n- numărul termenilor săi independenți (factori de echilibru intern), sau numărul acelor corpuri a căror concentrație poate fi modificată independent; e- numărul factorilor externi de echilibru (aceștia sunt: temperatura, presiunea, tensiunea capilară, forța electro-excitatoare, diverse solicitări gravitaționale etc.); r- numărul de faze, adică stări fizic diferite ale materiei, separate (r - 1) după numărul de interfețe. Această expresie decurge din articolele lui Gibbs însuși, dar a fost scrisă mai întâi de Wald („Zeitschrift f. Ph. Ch.” 18, 1895, 346) și, prin urmare, în cuvinte (cf. A. Gorbov, „Legea fazelor” , „Fizic. Mat . Anual.”, II) că fiecare corp nou care intră în sistem, și fiecare nou factor extern al echilibrului său, măresc cu unul gradul de libertate al sistemului (numărul de faze posibile, posibile variații independente ale temperatura, presiunea etc.), iar fiecare faza noua sau interfata nou formata scade acest grad de libertate cu 1. Legea fazelor este un fir de ghidare de nepretuit in studiul transformarilor materiei.
II. A doua lege calitativă generală care determină direcția transformării este Legea lui Gibbs-Le Chatelier , afirmând că „orice modificare a oricărui factor de echilibru atrage după sine o transformare în sistem, care tinde să provoace în acest factor o schimbare de semn opusă celei care îi este comunicată”. Această lege este menționată și mai devreme (vezi Reversibilitatea reacțiilor chimice).
Legi cantitative, de greutate.
eu. Legea conservării masei materiei exprimat de Lavoisier într-o formă a priori: „Putem recunoaște ca o axiomă”, spune el, „că cu toate transformările, atât artificiale, cât și naturale, nimic nu este creat din nou: aceeași cantitate de materie există înaintea experienței și după aceasta [Debus („U é ber einige Fundamentalsatze der Chemie etc.”, 1894, 6) consideră că Democrit de Abdera este întemeietorul unei astfel de convingeri, care a învățat că nimic nu poate ieși decât din nimic și nimic din ceea ce există se poate transforma în nimic. ; citat de Aristotel în Fizica sa (I, 4)]. Pe acest principiu se bazează posibilitatea tuturor experimentelor chimice și suntem obligați de el să ne așteptăm întotdeauna la o identitate reală, sau egalitate, între esențele corpurilor studiate și cele care pot fi extrase din ele prin analiză” (Lavoisier, „Oeuvres etc." I , 101); nu există totuși nicio îndoială că această poziție a fost la Lavoisier rezultatul a numeroase observații experimentale (vezi Phlogiston, Formule și Nomenclatură Chimică). Întrucât pentru un punct dat de pe glob, masele oricăror corpuri sunt strict proporționale cu greutățile lor, putem spune că, conform legii lui Lavoisier: în orice transformare, greutatea corpurilor transformatoare este strict egală cu greutatea celor formate și este ușor de observat că această lege „chimică” reprezintă caz special altul, mai general, căruia îi sunt supuse toate mişcările materiei şi constând în faptul că de fiecare dată când masa unui corp dat se modifică (crește sau scade), atunci masa unuia sau mai multor corpuri înconjurătoare suferă o modificare simultană egală ca mărime, dar de semn opus (screște sau crește)[Gaultier și Charpy „Le ç ons de Chimie”, 1900, 14] [Legea conservării masei materiei este destul de paralelă cu legea conservării energiei în fizică (cf. B. Stevarta. P. G. Tait, „Univers nevăzut”. ", 1890).]. Când Stas a sintetizat iodură și bromură de argint din cantități cântărite de argint, iod și brom, greutatea compușilor halogen, totuși, s-a dovedit a fi ceva mai mică decât argintul și iod, argint și brom, cântăriți separat; în plus, L. Meyer („Moderne Theorien d. Ch.”, 1884, 135) a indicat posibilitatea ca particulele materiei noastre ponderabile să fie conectate cu o cantitate mai mare sau mai mică de eter de lumină nu chiar lipsit de greutate, a cărui cantitate, poate, modificări cu transformări chimice; având în vedere aceasta, mai întâi Landolt, iar după el Heidweiler, au supus legea lui Lavoisier unui test experimental amănunțit; ambii au studiat modificările de greutate ale diferitelor sisteme închise în vase de sticlă sigilate. Landolt a constatat că greutatea sistemului: o soluție apoasă de sulfat de argint + o soluție de sulfat feros acidificat cu acid sulfuric scade în timpul reacției:
Ag 2 SO 4 + 2FeSO 4 + H 2 SO 4 = 2Ag + Fe 2 (SO 4) 3 + H 2 O
la 0,130 mg - 0,167 mg; această scădere depășește eroarea de cântărire de 6 - 12 ori, dar este disproporționată față de masele de reacție, întrucât a fost de = 0,130 mg la 171,3 g și 0,167 mg la 114,2 g din sistemul de reacție; în reacția acidului iod. cu iodură de hidrogen în prezență de acid sulfuric:
HJO3 + 5H2SO4 + 5KJ \u003d 3J 2 + 5KHSO 4 + 3H 2 O
s-a observat și o scădere a greutății, dar diferența (0,011 mg - 0,047 mg) s-a aflat în eroarea experimentală; în timpul reacției iodului cu o soluție apoasă de sare de sulfură de sodiu (interacțiunea poate merge în două direcții:
J 2 + 2Na 2 SO 3 \u003d 2NaJ + Na 2 S 2 O 6
J 2 + Na 2 SO 3 + Η 2 Ο \u003d 2HJ + Na 2 SO 4,
hidrat de cloral cu potasiu caustic
[CCl 3 .CH (OH) 2 + KOH \u003d CCl 3 H + SNKO 2 + H 2 O]
iar când hidratul de cloral a fost dizolvat în apă, nu a fost observată nicio modificare a greutății care să nu se încadreze în eroarea experimentală. Heidweiler a studiat următoarele transformări: deplasarea cuprului de către fier în soluții acide, bazice (?) și neutre de sulfat de cupru, dizolvarea sulfatului de cupru în apă, dizolvarea celui acidulat în apă și a celui mijlociu în acid sulfuric, precipitarea hidratului de oxid de cupru cu potasiu caustic dintr-o soluție de vitriol de cupru, interacțiunea amoniacului cu acidul acetic și precipitarea clorurii de bariu cu acid sulfuric. Cu un număr total de corpuri de reacție de aproximativ 200 g (160 - 280) și cu o eroare de cântărire care nu depășește 0,04 mg, în două cazuri a observat o creștere în greutate de 0,014 și 0,019, iar în restul de 21 scăderi în greutate; în 13 experimente a fost mai mare decât eroarea posibilă și odată a ajuns la 0,217 mg; fără îndoială, s-a stabilit o scădere la precipitarea cuprului într-o soluție acidă și alcalină (dar nu în una neutră), la dizolvarea sulfatului de cupru acidificat în apă și la precipitarea hidratului de oxid de cupru [În 2 experimente, s-a observat totuși o scădere prea neglijabilă și anume 0,037 și 0,032 mg]. Heidweiler nu a putut să-și dea seama de motivul schimbării în greutate și, în plus, pierderea în greutate nu a fost proporțională cu masa corpurilor care reacţionează. Astfel, rezultă că, în timpul anumitor transformări, masa materiei transformate pare să scadă, iar această scădere se află în afara limitelor erorilor de cântărire; nu se poate explica (Landolt) prin tensiuni diferite gravitatieîn raport cu mase egale ale unor corpuri diferite, întrucât experimentele lui Bessel cu pendulele din diferite metale și minerale și Eötvös (E ötvö s) cu greutăți de torsiune au arătat că o astfel de diferență nu poate fi surprinsă; pe de altă parte, retragerile par a fi disproporționate cu masele care reacţionează, iar acest lucru face probabilă o eroare întâmplătoare; atâta timp cât se poate, se pare, să se considere în continuare legea lui Lavoisier, în cadrul acurateței metodelor moderne de observație, perfect exactă. În orice caz, erori ca cele de mai sus nu pot fi luate în considerare în experimentele obișnuite [Pentru ca un sistem de sulfat de cupru bazic cu fier să piardă 1 pud în greutate după reacție, este necesar, judecând după datele lui Heidweiler, să se ia în considerare cel mai favorabil caz un pic mai mult de 1.000.000 puds. . amestecuri. Cel mai recent, Heidweiler a raportat (Physikalische Zeitschiift, 1902) că greutatea radiului dintr-un tub etanș scade cu 0,02 mg pe zi și este remarcabil faptul că scăderea energiei potențiale datorită acestui fapt. (= K×[(M Δt)/r 2 ]×r, Unde K rapid., M masa pământului, r- raza sa, Δt modificarea masei unui corp atras de Pământ) = 0,02,600000000 mg cm = aprox. 12,10 ergi, adică doar energia emisă, conform lui Becquerel, de radiu pe zi. Raportul lui Heidweiler este preliminar.].
II. Legea constanței compoziției compușilor chimici care poate fi formulat astfel: masele de corpuri care, prin combinarea lor, formează un nou corp care are o sumă dată de fizice şi proprietăți chimice, sunt în relație constantă atât între ele, cât și cu masa corpului format, este de obicei considerată cea mai caracteristică a chimiei; este definită uneori chiar ca o știință care studiază compoziția și transformările numai ale corpurilor omogene, adică acelea care se caracterizează printr-o compoziție constantă, care reprezintă indivizi chimici reali și cărora li se dă numele anumitor compuși chimici, în contrast. la amestecuri mecanice și compuși chimici nedefiniti (?) (vezi Tikhvinsky, „Metoda și sistemul chimiei moderne”, Sankt Petersburg, 1900, 3 și 6). Pe de altă parte, se poate găsi un comentariu despre această lege (Gautier et Charpy, l.c., p. 14) că „nu reprezintă altceva decât o tautologie. Într-adevăr, nu există altă definiție a unei „anumite” conexiuni, cu excepția celei care derivă din această așa-numită lege. proprietăți fizice nu este suficient pentru a caracteriza compusul; astfel, observăm proprietăți destul de definite pentru un amestec de apă și alcool, luat într-un anumit raport (în greutate), deși nimeni nu privește niciodată acest amestec ca pe un compus. Aici, așadar, nu există o lege reală, ci o afirmare a unui fapt, totuși unul foarte remarcabil. Și anume, multe elemente pot forma corpuri complexe numai prin combinarea în anumite proporții care rămân neschimbate, indiferent de modalitatea de obținere a unui corp complex; dacă unul dintre elemente este în exces, atunci va rămâne, ca atare, după actul de combinare.„Wald spune și mai tăios („Zeitsch. f. ph. Ch.”, 1897, 22, 256): legea empirică. . Dar nici acest lucru nu este complet corect. Trebuie doar să ne întrebăm, ce va face chimistul dacă o substanță, care era considerată un compus chimic - și acest lucru nu este atât de rar - se dovedește că își schimbă compoziția în condițiile schimbătoare? Se va îndoi de corectitudinea legii? Evident nu; va șterge doar substanța din lista compușilor chimici... Cert este că nu există alte semne care să recunoască substanța ca compus chimic... Deci, experiența a arătat că unele corpuri complexe au o compoziție constantă. Admiterea că toate aceste substanțe, și numai ele, trebuie considerate compuși chimici este arbitrară. În consecință, compușii chimici au o compoziție constantă în virtutea definiției, iar prin definiție, acele corpuri care nu îndeplinesc această condiție nu sunt recunoscute drept compuși chimici. „Se pare, având în vedere cele de mai sus, este interesant de aflat în ce relație este legea constanței compoziției cu legea lui Lavoisier, istoria originii ei și ceea ce trebuie să considerăm acum ca un amestec mecanic, compuși chimici nedeterminați și definiți Legea lui Lavoisier cere ca masa corpurilor care reacţionează să fie egală cu masa lui noul corp s-a format din ele, dar nu prejudecă deloc cantitățile de corpuri care reacţionează; atâta timp cât acestea sunt mai mari decât zero, ele îl satisfac; legea lui Lavoisier nu prejudecă întrebarea dacă corpurile nu pot reacționa în nenumărate rapoarte; legea constanței compoziției spune că o reacție este posibilă numai pentru un anumit raport specific al maselor care reacţionează, dar, de asemenea, nu oferă instrucțiuni cu privire la numărul de compuși posibili. Este remarcabil că chimiștii au fost mult timp convinși instinctiv de constanța compoziției corpurile pe care le studiază; este suficient să subliniem că compoziția sărurilor a fost determinată de: Bergman (între 1775-1784); Wenzel (1777), Kirwan și Richter (1790-1800); că Lavoisier, după ce a determinat compoziția dioxidului de carbon și a apei, a început să studieze compoziția compusi organici , pe care l-a ars pentru aceasta, a colectat apa și dioxidul de carbon rezultat și a calculat conținutul de carbon și hidrogen din substanța arsă etc.; iar acest lucru, evident, ar fi imposibil dacă ar permite ca compoziția apei și a dioxidului de carbon să se schimbe. Astfel, credința în constanța compoziției corpurilor complexe a existat de mult timp, sau mai bine zis, nimeni nu bănuia posibilitatea de altceva, dar „legea” a rămas nespusă. Adversarul său decisiv a fost Berthollet („Recherches sur les lois de l” afnnt é”, 1801 și 1802 și „Essai de statique chimique”, 1803). Era convins că corpurile pot fi uneori legate în tot felul de moduri, alteori în cunoscute. limite; el a văzut motivul acestei limitări în faptul că forța cu care părțile constitutive sunt ținute într-un corp complex trebuie să scadă odată cu creșterea masei unuia dintre corpurile care reacţionează (pe măsură ce acesta se apropie de o stare de saturație și o scăderea relativă a masei celuilalt) și, în al doilea rând, a influenței temperaturii asupra coeziunii și asupra elasticității naturale a corpurilor care reacţionează. Datorită înaltei autorităţi a lui Berthollet, datorită inteligenței cu care au fost exprimate aceste opinii, au câștigat multe susținători, mai ales că datele analitice disponibile atunci erau în multe privințe o confirmare directă a corectitudinii unor astfel de opinii.Proust (Proust, vezi articolul corespunzător) a fost un oponent al ideilor lui Berthollet [Proust este creditat în acest articol cu ideea de originea elementelor chimice dintr-o materie primară, și anume hidrogenul, dar această idee a fost exprimată de medicul englez Prout (Prout) (vezi) și Atomii de greutate (vezi).]; într-o serie de lucrări (1801-1808) a arătat că formarea de oxizi, compuși ai sulfului și săruri, în general, este asociată cu relații certe și invariabile între masele elementelor găsite în ei, dar ceea ce este vizibil doar dacă distinge amestecuri mecanice și alte amestecuri eterogene din punct de vedere fizic și chimic de compuși chimici. Legea constanței compoziției acestora din urmă, și anume oxizi, a fost exprimată de Proulx în 1801 în următoarele cuvinte (Corr, „Geschichte d. Ch.”, II, 368): „Proporții mereu neschimbate, aceste atribute constante, caracterizează compuși reali, atât artificiali, cât și naturali, într-un cuvânt, acest pondus naturae, pe care Stahl îl vede atât de clar; toate acestea, zic eu, nu sunt mai mult în puterea chimistului decât legea electorală la care sunt supuși toți compușii. Compușii „determinați” se pot amesteca, potrivit lui Proulx, între ei în cei nedefiniti. relații, dar produsul unei astfel de amestecări nu este un compus chimic, ci o soluție. Berthollet considera (în „Statique chimique”) că părerile lui Proulx nu aveau nici un fundament, iar între ele a izbucnit o dispută, care s-a încheiat în 1808, când majoritatea contemporanilor săi s-au aplecat de partea lui Proulx, după care un studiu intensiv al anumitor compuși chimici a început. În prezent, este cert că problema ar trebui revizuită. Pentru a ne da o idee despre punctul de vedere modern, să ne oprim asupra celui mai simplu caz de interacțiune a oricăror două corpuri care nu formează între ele ceea ce se numește un compus definit, dar sunt capabile să se formeze în anumite condiții. lichid și în toate direcțiile sisteme omogene. După cum se știe (cf. Regula fazei, Aliaje, Evaporare Fracționată), adăugarea unui corp ÎN la corp A A,și adăugarea corpului A la corp ÎN determină scăderea temperaturii. topirea corpului ÎN, si prin urmare, cand aplicam tot felul de amestecuri formate din aceste doua corpuri, pe o diagrama de temperaturi si concentratii, obtinem doua curbe care se intersecteaza in punctul eutectic, emanand din punctul de topire. AȘi ÎN(vezi poza):
Un studiu detaliat al diagramei arată următoarele. Peste curbe CEȘi ED avem zona sistemelor lichide, numită de obicei soluție ÎN V A (A se topește mult mai jos B) dar care, evident, sunt și soluții A V ÎN. Deasupra liniei punctate orizontale pornind de la punct D, ambele corpuri se amestecă ca lichide în toate felurile (de la 100% A pana la 100% ÎN);între această linie și linia punctată orizontală care începe în punct CU, corp A, lichid în aceste condiții, poate fi adăugat la soluție într-o cantitate nedeterminată fără a încălca omogenitatea acesteia și adăugarea unui corp ÎN limitat de curba sa de solubilitate DE; soluția datorită acestui fapt este, parcă, unilaterală. Sub linia punctată orizontală care începe în punctul respectiv CU, ambii solide dar au o capacitate limitată de a se topi reciproc; solutia este simetrica. Sub linia punctată ab ambele corpuri pot fi luate în orice relație, dar nu au nicio influență unul asupra celuilalt; sunt absolut indiferenți chiar și cu o scădere suplimentară a temperaturii și nu suntem capabili să-i aducem în interacțiune în aceste condiții (se presupune că factorii de echilibru extern ai sistemului sunt temperatura și presiunea vaporilor A + B).Într-un triunghi CaE precipită în stare solidă în exces de solid A,în contact şi echilibru cu corpul saturat cu acesta A, soluţie; într-un triunghi DbE precipită în stare solidă b, tot în contact şi în echilibru cu o soluţie saturată cu aceasta. Ce se află în dreptunghi AaBb sunăm de obicei amestec mecanic, deși de fapt nu există amestecare a corpurilor luate [Prin negarea amestecării corpurilor, înțelegem relația lor indiferentă între ele și izolarea lor spațială completă. Fără îndoială că oarecare conglomerat metalic eutectic (vezi Aliaje) dă impresia unui corp omogen cu ochiul liber la microscop.]; sunt la fel de amestecate ca și cum ar fi în dispozitive separate; prin urmare, este mai corect să numim un astfel de amestec „mecanic” împreună cu B. Rooseboom (vezi Stereoizomerie) un conglomerat; părțile constitutive ale unui conglomerat pot fi separate unele de altele prin diverse metode și, printre altele, cu ajutorul lichidelor grele (metoda lui Church și Thule în mineralogie). Compoziția unui astfel de conglomerat poate varia de la aproape 100% A pana la 100% b, dar este evident că pentru orice amestec dat acesta va rămâne constant, sub o serie întreagă de schimbări de temperatură; și dacă îl considerăm un compus definit sau nu va depinde de ușurința mai mare sau mai mică cu care putem demonstra neomogenitatea sa fizică în diferite puncte ale sistemului și de disponibilitatea mai mare sau mai mică a punctului eutectic pentru noi. E, peste care eterogenitatea conglomeratului va avea un efect mai clar (în stare solidă vor fi corpul A sau corpul ÎN), cu excepția cazului în care concentrația sa corespunde accidental punctului eutectic, când și mai sus substanța sa va fi tratată ca fiind complet omogenă, pentru care temperatura eutectică va fi punctul de topire [Că un astfel de conglomerat se topește la temperatura eutectică într-un lichid omogen este dovedit de experimentele lui Gallock (1888), care a descoperit că un conglomerat de rumeguș de cadmiu (1 oră), staniu (1 oră), plumb (2 ore) și bismut (4 ore), corespunzând ca compoziție aliajului Wood, se topește într-un baie de apă (cu o încălzire suficient de lungă), adică sub 100°, în timp ce metalele individuale se topesc: Cd la 320°, Sn la 32°, Pb la 320° și Bi la 269,2°; a constatat, de asemenea, că este suficient să se preseze potasiu (pl. la 62,5 °) și sodiu (pl. la 97,6 °) unul pe altul cu suprafețe proaspete pentru a le obține lichide la obișnuit. ritm. și un aliaj asemănător mercurului (soluție).]. Apoi corpuri AȘi ÎN, precipitate sub formă solidă din soluție vor avea, de asemenea, o compoziție nemodificată, deoarece se presupune că se pot topi fără descompunere (modificări ale compoziției) și, în plus, se presupune că avem un astfel de caz de interacțiune a lor când doar concentrația lor se modifică atunci când intră în soluție pe unitatea de volum, dar nu compoziția [De fapt, un astfel de caz ideal nu are loc de fapt: și cristalele corpului A,și cristalele corpului ÎN cad, umezit cu o soluție saturată, a cărei compoziție se modifică în funcție de temperatură și poate chiar să difere din cauza capilarității, ca compoziție de restul masei lichide. O astfel de soluție este însă relativ ușor de înlăturat, iar acesta este motivul reprezentării prezentate în text. Că cristalele de gheață cad din „slab” solutii apoase, nu reprezintă soluții solide, este clar din datele lui Regnault privind presiunea de vapori a unor astfel de soluții și din unele dintre observațiile lui Rüdorf asupra soluțiilor apoase slabe de săruri pleocroice.]. În cele din urmă, soluția va avea o concentrație variabilă atâta timp cât compoziția sa corespunde zonei situate deasupra liniilor CEȘi ed,și atâta timp cât unul dintre factorii externi de echilibru, temperatură (la presiune constantă) sau presiune (la temperatură constantă), sistemul se va schimba; dar cât de curând avem o soluție corespunzătoare uneia dintre curbele limită GE. sau ed, adică unul dintre cele două sisteme monovariante posibile, iar valoarea temperaturii sau presiunii sistemului este dată în avans sau imediat pentru soluțiile de mai sus CEȘi EDși reprezentând sisteme divariante, valorile temperaturii și presiunii sunt fixe, astfel încât compozițiile unor astfel de soluții se dovedesc a fi complet fixe, definite și se știe de mult timp că compoziția soluțiilor saturate este determinată de temperatură și de natura și starea corpului solid în contact cu acestea, și că pentru a avea o soluție nesaturată a unor corpuri având la o anumită temperatură o anumită presiune a vaporilor, o greutate specifică dorită și posibilă, un indice de refracție a luminii dorit etc. ., că pentru toate acestea corpurile care reacţionează trebuie luate într-un „raport constant de greutate” strict definit. Astfel, ajungem la concluzia că toate sistemele invariante (nevariante) au o anumită compoziție [Raționamentul aplicat în text unui sistem cu două corpuri poate fi ușor extins la un sistem de orice complexitate. Conglomeratul situat sub temperatura eutectică nu va consta întotdeauna din corpuri pure. AȘi ÎN; Ultimul caz apare când AȘi ÎN da legături. Dar nu este greu de înțeles astfel de cazuri, ghidându-te după cele de mai sus și cunoscând diagrama corespunzătoare; vezi, de exemplu, diagrama de solubilitate Fe 2 Cl 4 dată de V. Rooseboom în art. Evaporare fracționată.]; constanța sa, așadar, nu reprezintă privilegiul compușilor „anumiți, chimici” și, prin urmare, este urgent necesar să se găsească pentru „anumiți, compuși chimici”, a căror descriere până acum constituie aproape întregul conținut de X., unele alt semn decât constanța compoziției, care ar permite să le caracterizeze. Acest semn a fost dat de Wald, care a definit un compus chimic permanent, ca o fază de compoziție neschimbată într-un sistem monovariant. În cazul discutat mai sus, aceste faze sunt solide AȘi ÎNîn contact cu soluțiile sale saturate: odată cu creșterea temperaturii acestora din urmă, cu o modificare a presiunii acestora, compoziția soluției este în continuă schimbare, iar faza solidă, deși se modifică constant în cantitate [Masa întregul sistem este presupus a fi constant.], dar își păstrează compoziția neschimbată, individualitatea sa. Nu există nicio îndoială că semnul indicat de Wald este cunoscut de multă vreme chimiștilor și l-au folosit constant atunci când au descoperit compuși „permanenți, chimici”, dar înainte de Wald nu a fost formulat clar de nimeni, iar definiția compușilor „chimici” în manuale era deci incompletă. În experiment însă, pentru a stabili „omogenitatea” unei substanțe, a fost întotdeauna necesară cristalizarea acesteia din diferiți „solvenți” și la temperaturi diferite, adică forțarea acesteia să joace rolul unui corp. ÎN exemplul nostru; trebuia să determine greutatea vaporilor săi și comparați compoziția vaporilor cu compoziția corpului lichid (solid) etc. Ce explică, sau, mai corect, ce înseamnă împrejurarea că corpurile AȘi ÎNîși păstrează compoziția neschimbată într-un interval de schimbări de temperatură și presiune? Ideea este că dacă corpurile AȘi ÎN exotermice, își păstrează compoziția atâta timp cât le studiem la temperaturi sub acele temperaturi la care pot începe reacțiile de disociere în ele. A pe A 1 Și A 2, V pe b 1Și b2; dacă AȘi ÎNîn condițiile experimentului, compușii sunt endotermici, apoi își păstrează individualitatea atâta timp cât îi aducem în contact reciproc peste o anumită temperatură limită, sub care cu greu pot exista, gata să se dezintegreze în părțile lor componente [În astfel de condiții, există de obicei toți compușii „endotermici”, dintre care unii sunt enumerați mai sus. Reamintim că peroxidul de hidrogen, un „compus endotermic”, se formează într-o flacără de gaz detonant, că Si 2 Cl 6 (Troost și Hautefeuille) se formează din SiCl 4 și Si peste 1300 °:
începe să se descompună sub această temperatură și este complet disociat deja la 800°. Dar dacă un gaz încălzit la 1300° este răcit brusc, atunci se obține un lichid, kip. la 140° și începe să se descompună abia la aproximativ 350°C; dedesubt se pastreaza datorita rezistentelor pasive. mier Fosfor - pe cercetările lui Tamman privind condițiile transformărilor sistemelor suprarăcite (endoterme).] Apoi își păstrează individualitatea atâta timp cât îi aducem în interacțiune la presiuni mai mari decât presiunile de disociere inerente reacțiilor lor de descompunere; sau, în fine, cu sisteme endoterme, când le studiem la un asemenea grad de suprarăcire, când transformarea care se petrece în ele (dacă are loc) este practic insesizabilă pentru noi. În consecință, constanța compoziției este stabilită de condițiile alese pentru experiment. Dar de ce nu se formează compușii în toate proporțiile posibile, ci în cea mai mare parte (cf. Hidrocarburi) într-un număr foarte limitat dintre ei? Wald răspunde la aceasta subliniind solubilitatea reciprocă limitată a solidelor [Pentru a înțelege acest lucru pentru dvs., este suficient să studiați curbele de solubilitate ale hidraților de clorură de calciu (vezi Regula fazelor l. c.) sau clorură de fier(vezi Evaporarea fracționată l.c.), unde se vede că solubilitatea apei în sărurile halogenuri luate în stare solidă corespunde doar unui număr foarte limitat de proporții.] și derivă (l.c.) din această poziție chiar și legea rapoartelor multiple. (vezi . mai jos), dar nu există nicio îndoială că, în plus, un număr limitat de compuși se datorează și așa-numitei naturi chimice a corpurilor, ceea ce face, de exemplu, că pentru hidrogenul cu oxigen, numai apa este numai compus stabil (exotermic) în condițiile noastre, iar restul sistemelor (H 2 O 2 , H 2 O 4 ?), care conțin mai mult oxigen la temperaturile și presiunile noastre, nu sunt foarte stabile (suprarăcite) și cu greu pot fi stocate pentru o perioadă scurtă de timp. Apoi, după cum se poate vedea din exemplele prezentate, această limitare este evidentă, datorită condițiilor limitate aleatoriu („obișnuite”) în care studiem interacțiunile diferitelor corpuri. Dar dacă se observă cazuri de solubilitate limitată, atunci ar trebui de așteptat și fenomenul opus, adică cazuri de amestecare completă a corpurilor în stare solidă în toate modurile posibile, în caz contrar, ar trebui să se aștepte formarea unor astfel de sisteme care, având caracteristicile obișnuite ale compușilor „chimici”, vor diferi de acestea prin incertitudinea completă a compoziției. Unele dintre fenomenele legate de aceasta sunt de obicei descrise ca amestecuri izomorfe (vezi articolul corespunzător), în timp ce unele sunt descrise în general sub denumirea de soluții solide (van "t Hoff, Mallard, Klein, Runne, Buxhoevden u. Tammann). Având în vedere interacțiunea corpurilor de mai sus AȘi ÎN din punctul de vedere al legii fazelor, nu am hotărât dacă aceste corpuri sunt elemente, sau dacă sunt complexe „chimic”. Cert este că legea nu face nicio diferență între elemente și compușii lor și este în egală măsură aplicabilă atât fenomenelor de dizolvare a hidraților de clorură de calciu în apă (vezi Regula fazelor), cât și interacțiunii a două elemente, clor și iod (l. c .). Singura diferență cunoscută până acum între elemente și corpuri compuse este că acestea nu au fost descompuse în mod tangibil în nicio formă de materie diferită de ele și, prin urmare, încă aderăm la definiția lui Lavoisier (vezi Nomenclatura chimică); singura diferență este că, având în vedere legea lui Dulong și Petit (vezi Căldura) și legea periodică a lui D. I. Mendeleev (vezi Legea periodică a elementelor chimice), putem afirma cu un grad mare de probabilitate că toate elementele moderne, dacă sunt complexe , atunci complexitatea lor este de aceeași ordine [„Zi de zi transformăm materia în toate felurile posibile. Dar, în același timp, am definit cu precizie granițele unde se opresc astfel de transformări: nu au depășit niciodată atât de mult dincolo de... chimie. Elemente.Această limită nu ne este indicată de nicio teorie filozofică, acesta este un obstacol de fapt pe care noi, cu metodele noastre de efectuare a experimentelor, nu am fost capabili să-l depășim... Înseamnă aceasta, totuși, că mental vedem aici finalul? Nu, fără îndoială, de fapt, chimiștii au privit întotdeauna această graniță ca pe un fapt incontestabil, dar întotdeauna cu speranța de a o depăși. M. Berthelot, „Les origines de l” Alchimie „(1885).] Recent, mulți și-au exprimat deja convingerea că s-a realizat o simplificare a elementelor noastre; de exemplu, J. J. Thomson consideră că această presupunere nu poate fi decât fenomenele observate. în timpul trecerii razelor catodice în gazele rarefiate se explică: „Deoarece razele catodice poartă sarcini negative; deviate de forțele electrostatice ca și cum ar fi încărcate negativ; sunt supuse acțiunii unei forțe magnetice exact în același mod ca și când această forță ar acționa asupra unui corp încărcat negativ care se mișcă pe calea acestor raze, atunci nu văd nicio modalitate de a evita concluzia că ele reprezintă negativ sarcini electrice transportate de particule de materie. Întrebarea este, ce sunt aceste particule? Reprezintă atomi, molecule sau materie într-o stare de mare separare? Pentru a face lumină asupra acestei împrejurări, am făcut o serie de măsurători ale raportului dintre masa acestor particule și sarcina pe care o poartă”; ca urmare, s-a dovedit că m/e(m- greutate, e- sarcina) nu depinde de natura gazului si este foarte mica (= 10 -7) fata de cea mai mica astfel de valoare cunoscuta pana acum, si anume - 10 -4, care corespundea ionului de hidrogen in timpul electrolizei solutiilor apoase. de acizi, de ce Thomson a concluzionat că în condiții catodice „avem de-a face cu o nouă stare a materiei, o astfel de stare când diviziunea ei este avansată mult mai departe decât în starea gazoasă; o astfel de stare când diferite tipuri de materie, adică provin din hidrogenul, oxigenul etc., devin identice”, etc. În ciuda numeroaselor lucrări în acest domeniu, problema a avansat relativ puțin din cauza dificultăților experimentale; prin urmare, se cuvine doar să o schițăm aici și, de altfel, să cităm recenzia lui Ostwald, conform căreia „legea de bază a electrolizei, legea lui Faraday, s-a dovedit a fi complet inaplicabilă materiei sau corpurilor care transportă curent în gaze. Această contradicție. este exprimată într-o asemenea formă încât, se presupune că, cercetările asupra conductivității gazelor au demonstrat existența unor particule materiale de câteva sute de ori mai mici decât o moleculă de hidrogen (de 200 de ori); dar natura ipotetică a unei astfel de concluzii este evidentă, iar denumirea de ioni pentru aceste fenomene, urmând legi complet diferite, este inadecvată” (1901). Trebuie să așteptăm o explicație experimentală ulterioară a subiectului.
III. Legea echivalentelor (cf. Sistem unitar). Bergman observase deja că atunci când se amestecă soluții de două săruri neutre, neutralitatea soluției nu este perturbată, dar nu a acordat suficientă atenție acestei circumstanțe. Primul sa angajat într-un studiu amănunțit al fenomenului lui Wenzel (1740-43), care a pus bazele stoichiometriei cu lucrarea sa „Vorlesungen über die chemische Verwandtschaft der Kö rper” (1777) (vezi). Confirmând corectitudinea observațiilor lui Bergmann, Wenzel a dat o explicație a acestora, care a constat în faptul că cantități diferite de alcalii și pământuri diferite, neutralizând aceeași cantitate de orice acid, ar trebui să neutralizeze cantități egale de orice alți acizi; cu alte cuvinte, că raportul dintre masele a două pământuri care neutralizează o anumită cantitate de acid rămâne constant chiar și atunci când neutralizează toți ceilalți acizi, iar acest lucru a făcut posibilă verificarea analizelor și chiar calcularea cantității de bază necesară pentru formează o sare medie cu un acid dat, dacă se cunoaște cantitatea de o singură bază necesară în acest scop; Wenzel însuși, însă, nu a acordat o importanță deosebită acestei împrejurări, iar opera sa nu a fost apreciată de contemporani, deși era foarte exactă pentru acea vreme. Nu a fost mai fericit și cel mai apropiat adept al lui Wenzel - Richter. Richter a început (1789-1802) prin aranjarea în serie a greutăților relative în care acizii se combină cu bazele pentru a forma săruri neutre. Numărul de baze necesare pentru a neutraliza 1000 de ore de acid sulfuric, el a numit seria neutră (Neutralit ä tsreihe) de baze; în același mod, a determinat seria neutră a diferiților acizi necesari neutralizării unor cantități date de diverse baze. În ciuda acurateței relativ scăzute a cifrelor sale, Richter a observat că numerele serii neutre de baze sunt proporționale între ele și că același lucru este valabil și pentru seria neutră de acizi. În legătură cu aceste lucrări, există o altă „descoperire” a lui Richter, și anume, el deține observații extinse asupra cantităților în care metalele se deplasează (vezi. Deplasarea) unele pe altele din sărurile neutre, adică determinarea acelor cantități în care acestea se combină cu o cantitate constantă de oxigen, iar în cazul în care metalele sunt înlocuite din sărurile unui acid și acele cantități în care acestea, sub formă de oxizi, sunt combinate cu o cantitate constantă de anhidridă acidă [Pentru a clarifica acest lucru, este suficient să prezinți sulfatul de cupru ca un oxid de cupru compus cu anhidridă sulfurică și să scrieți ecuația pentru deplasarea cuprului de către fier:
CuO.SO3 + Fe = FeO.SO3 + Cu;
arată: de la 16 gr. unitati oxigenul este combinat 63 wt. unitati cupru și 56 wt. unitati fier (Cu = 63 și Fe = 56 în numere rotunde), și că (63 + 16) greutate. unitati oxid de cupru și (56 + 16) în greutate. unitati oxizii de fier sunt combinați cu 80 wt. unitati anhidridă sulfurică (S = 32 în numere rotunde)]. Anterior, Bergman a studiat deplasarea reciprocă a metalelor și și-a publicat observațiile în articolul: „De div e rsa phlogisti quantate in metallis”. El a descoperit că, pentru a înlocui argintul din sarea sa de acid azotic, sunt necesare cantități destul de precise și constante de alte metale; apoi a studiat deplasarea reciprocă a metalelor din alte săruri; s-au observat diferenţe mari în cantităţile de metale precipitante, dar supuse unor legi constante. Ca susținător al teoriei flogistului, Bergman și-a privit figurile astfel: fiecare metal, atunci când este dizolvat, se transformă în „var”, adică pierde flogistonul conținut în el (vezi); și întrucât, atunci când este precipitat de un alt metal, precipită în stare metalică, este fără îndoială că este redus, se recombină cu cantitatea de flogiston necesară acestuia, în detrimentul metalului care îl precipită, iar Bergman, pe baza din experimentele sale, a concluzionat că diferite metale 1) sunt conectate cu cantități diferite de flogiston și 2) că cifrele pe care le-a obținut dau acele cantități de metale care conțin cantități egale de flogiston. 20 dec 1783 Lavoisier a prezentat Academiei un memoriu Sur la précipitation des substances mé talliques les unes par les autres (Oeuvres etc., II, 528), unde, arătând la rezultatele lui Bergmann, el spune că, „în opinia sa, absența sau prezența de flogiston în metale nu este altceva decât o presupunere. În realitate, și se poate recunoaște cu greutăți și măsuri în mână, că, cu orice calcinare a unui metal, fie că are loc uscat sau umed, cu ajutorul aerului, apei sau acizilor, se observă creșterea în greutate a unui metal cauzată de adăugarea acestuia de ... oxigen (princip e oxygè ne) ... și deci dacă 31 lb. de cupru sunt suficiente pentru a precipita 100 lb. de argint în metalul stare [Cifra reală este de 29,46 unități de greutate de cupru la 100 de unități de greutate de argint; experimentele lui Bergman în acest caz au fost eronate cu aproximativ 4%.], ceea ce înseamnă că această cantitate de cupru este capabilă să se combine complet cu tot oxigenul conținut în 100 de unități de greutate. fn. argint ... în stare de var "; Mai mult, Lavoisier nu ia în considerare remarca corectă tocmai făcută și, bazându-și calculele pe datele incorecte ale lui Bergman, ajunge la concluzii complet incorecte. Câțiva ani mai târziu, opera lui Richter apare cu date mai exacte și cu o explicație lipsită de contradicțiile din memoria lui Lavoisier. Richter stabilește, de altfel, că mercurul și fierul formează mai mulți compuși definiți cu oxigenul, dar el expune rezultatele muncii sale în cel mai înalt grad limbaj complicat, în plus, ele conțin numeroase calcule referitoare la o serie de legi imaginare pe care Richter credea că le-a descoperit. Aproape toate aceste lucrări trec neobservate, iar egalitatea cantității de oxigen este apoi descoperită din nou de Gay-Lussac (în 1808), iar existența diferitelor personal permanent oxizi de fier și mercur - Proulx în timpul disputei sale (vezi articolul corespunzător) cu Berthollet. În 1782, Fischer a acordat atenție lucrării lui Richter și a constatat că toate tabelele sale de serii neutre pot fi reduse la unul, constând din două rânduri: într-unul, cantitățile de baze exprimate în numere, iar în celălalt, cantitățile de acizi necesari formarii sarurilor neutre cu numarul de baze indicat. „Aceste numere exprimau, în consecință, relațiile de neutralitate dintre baze și acizi, iar tabelul care le-a încheiat a rezumat într-o formă clară și convenabilă compoziția un numar mare săruri neutre". Datorită lui Fischer, rezultatele lucrării lui Richter au devenit bine cunoscute, dar influența lor era încă foarte nesemnificativă, iar ceea ce a găsit a fost redescoperit ulterior. Între timp, Wenzel și Richter au descoperit faptul că, dacă două corpuri sunt legate de un al treilea. într-o oarecare privință A:B atunci ele se pot înlocui între ele în același raport într-o serie întreagă de corpuri complexe și, într-un caz particular, pot fi, în consecință, în același raport sau într-un multiplu al acestuia (vezi mai jos) să fie combinate între ele. Aceste numere caracteristice au fost numite de Wollaston - echivalente; în modern echivalentele manuale sunt definite ca (proporționale) numere care arată în ce cantități de greutate sunt combinate elementele cu o singură greutate. unitati hidrogen sau înlocuiți-l.
IV. Legea rapoartelor multiple deținut de Dalton; istoria originii sale nu poate fi acum reconstruită cu acuratețe; este de obicei formulat astfel: dacă două corpuri A și B sunt conectate în mai multe rapoarte, atunci masele corpului B pentru aceeași masă a corpului A sunt în raporturi multiple simple între ele și în același timp într-un raport simplu și multiplu cu echivalentul corpului B; o formulare mai generală se datorează lui Duhem (Le mixte et la combinaison chimique, 1902, 73): „Să C 1 , C 2 , C 3 ... vor exista diverse elemente; pentru fiecare dintre ele putem alege un număr caracteristic pentru acesta, numit număr proporțional (greutate „atomică”) și obținem, în continuare, un tabel de numere proporționale (greutăți „atomice”): p 1 , p 2 , p 3 ... Dacă corpurile C 1 , C 2 , C 3 ... sunt interconectate, atunci masele corpurilor de legătură sunt în relația: λр l , μр m , νр n ... Unde λ, μ, ν sunt numere întregi... Dalton și contemporanii săi nu s-ar fi mulțumit cu expresia „numere întregi”, ci ar fi spus „întregi numere prime"; dar această limitare, corectă la începutul chimiei, devine din ce în ce mai puțin adevărată pe măsură ce se dezvoltă; în special, succesele chimiei organice au forțat în multe cazuri să atribuie numerelor întregi. λ, μ, ν... valori mari; caracterul simplității, care le-a fost atribuit la început, a dispărut astfel; cum, de exemplu, să o găsim în formula parafinei, unde masele combinate de carbon și hidrogen sunt legate ca λ odată luată greutate proporţională („atomică”) a carbonului şi μ odată luată greutatea proporțională a hidrogenului și unde λ Și μ au semnificatii: λ = 27, μ \u003d 56?" Într-adevăr, formularea obișnuită a legii nu se aplică nu numai parafinelor (vezi), unde raportul dintre indicatorii din formulele pentru „greutățile proporționale” de hidrogen și carbon este transmis printr-o fracție. 2+2/n, dar în general tuturor serii nelimitate hidrocarburi, începând cu seria acetilenei, deoarece este succesiv egală cu: 2 - 2/n, 2 - 4/n, 2 - 6/n etc., unde n- numere întregi. Dar trebuie să fim atenți la faptul că în astfel de comparații aplicăm „legea” cazurilor care nu corespund exemplelor din care a fost derivată, iar atunci dezacordul ei cu observația nu este atunci nimic surprinzător. „Legea” a fost stabilită de Dalton la compararea gazului de mlaștină cu etilena și la studierea oxizilor de azot și nu trebuie decât să acordați atenție formulelor moderne ale acestor compuși pentru a vedea că au fost comparați compuși de diferite serii și diferite grade de oxidare. , într-un cuvânt - de diverse limite, dar cu o constantă masa unuia dintre elementele din ele; iar cu această restricție, „legea” este valabilă și acum, așa cum se vede chiar și în formulele hidrocarburilor, în comparație între ele, seria: C 2 H 2, C 3 H 2, C 4 H 2 .. ., CH4, C2H4, C3H4..., C2H6, C3H6, C4H6... etc.; într-o astfel de comparație, găsim atât numere întregi relativ simple, cât și regula că „masele corporale ÎN, pe greutate corporală constantă A, sunt în raporturi multiple între ele, exprimate ca rapoarte ale numerelor întregi; aceleași exemple pot servi și pentru a ilustra împrejurarea care i-a atras în special atenția lui Dalton și care constă în faptul că compușii „chimici” apar în salturi; este cu adevărat clar că pe H 2 are o masă de carbon egală cu 24, 36, 48, H 4 - 12, 24, 36 ..., H 6 - 24, 36, 48 etc., adică se repetă un număr foarte mic de numere și nu există continuitate.Pentru a explica acest lucru, Dalton și-a propus ipoteza „atomică” [Vezi „Alembic Club Reprints”, nr.2, 1893, „Foundations of Atomic Theory” de J. Dalton a. Wollaston (1802-1808) și Ostwald" s "Klassiker etc.", nr. 3.1889: "Die Grundtagen der Atomthéorie" von J. Dalton u. W H. Wollaston (1803-08). mier pe langa art. Debus "a (l. c.) Dahem" a (l. c.) și A. Hannequin, "Essai critique sur l" hypothese des atomes dans la science contemporaine "(P. 1899)]. Conceptul de structură atomică a materiei este, fără îndoială, de foarte origine antică (vezi Substanța), dar Dalton pare să o aibă (Roscoe a. Harden, „A New Wiew of the Origin of Daltons Atomic Theory, 1896; de exemplu, de asemenea, în Zeit. f. Ch., 1896), dezvoltat sub influența lui Newton, care avea nevoie de atomi pentru a-și construi teoria despre fluxul de lumină. Newton și-a dezvoltat punctul de vedere în întrebările care i-au pus capăt Opticii; Astfel, la Întrebarea XXXI, Newton întreabă: „Oare cele mai mici particule ale corpurilor nu au anumite proprietăți, abilități sau forțe care le permit să influențeze la distanță nu numai razele de lumină pentru a le reflecta, refracta și devia, ci și unul asupra celuilalt și provoacă în acest fel majoritatea fenomenelor naturale? Când două corpuri sunt conectate, Newton consideră legătura ca o consecință a atracției reciproce a celor mai mici particule ale ambelor corpuri la distanțe mici. „Când potasa se estompează, nu se datorează atracției reciproce dintre particulele sale și particulele de apă, care se repezi peste ele sub formă de abur, particule de apă? Motivul imediat al adoptării opiniilor atomice pentru Dalton a fost, se pare (eronată, după cum știm acum), observația că oxidul de azot poate reacționa complet cu oxigenul atmosferic sau în raport cu 36 voi. NU la 100 rpm aer, sau în raport cu 72 vol. NU pentru aceeași 100 rpm. aer, iar în primul caz se formează acid azotic, iar în al doilea acid azotic; „Aceste fapte”, spune el, „indică în mod clar teoria procesului: elementele de oxigen se pot combina cu o anumită cantitate de oxid nitric, sau dubla, dar nu cu oricare dintre cantitățile intermediare”. El a fost adus la vederi atomice prin studiul solubilităților diferitelor gaze în lichide și a presiunii gazului în amestecuri. Cel puțin, vedem că la mai mult de un an după experimentul menționat (6 septembrie 1803), el este ocupat „observând particulele finale (particulele finale) ale corpurilor și combinarea lor”, și la mesajul său „Despre absorbție”. de gaze prin apă și alte lichide, citită la 21 oct. 1803 („On the Absorption of Gases by Water and other Liquids”, retipărit abreviat în „Klassiker” al lui Ostwal, vezi mai sus) este atașat primul tabel al greutăților relative (foarte inexact), intitulat: „Tabelul greutăților relative ale ultimelor particule de gaze și alte corpuri"; în el sunt enumerate elementele: hidrogen, azot, carbon, oxigen, fosfor, sulf intercalate cu diverși compuși, între care se află unele substanțe organice și cu fiecare nume o figură de greutate relativă primește particule finite fără a explica cum a fost obținută de către autor În 1804, el i-a comunicat părerile profesorului Thomson (din Edinburgh), care l-a vizitat la Manchester, iar acesta din urmă le-a publicat (cu acordul lui Dalton) în volumul al treilea. din manualul său X. , publicat în 1807. În cele din urmă, în 1808, ele au fost expuse chiar de Dalton în „A New System of Chemical Philosophy” (vezi „Klassiker” l. p. a lui Oslwald). Următoarele pasaje caracterizează punctele cele mai semnificative ale opiniilor lui Dalton. „Asemenea observații (vorbim despre observații asupra celor trei stări ale corpurilor: gazos, lichid și solid) au condus pe toată lumea la un acord tacit că corpurile de dimensiuni apreciabile, fie că sunt lichide sau solide, constau dintr-un număr enorm de particule neobișnuit de mici. , sau atomi, materie ținută împreună printr-o forță de atracție, mai mult sau mai puțin semnificativă, în funcție de circumstanțe, pe care o numim coeziune atunci când împiedică separarea particulelor, sau ... afinitate atunci când le colectează dintr-o stare dispersată (de exemplu, când aburul se transformă în apă)... O întrebare destul de importantă este dacă particulele finale (ultimele) ale unei substanțe date, de exemplu apa, sunt aceleași, adică au aceleași aspect, aceeași greutate, etc. Pe baza a ceea ce știm, nu avem de ce să presupunem vreo diferență între ele, .. cu greu ne putem imagina că agregatele de particule neidentice ar putea fi atât de omogene. Dacă unele dintre particulele de apă erau mai grele decât altele și dacă, întâmplător, o parte din acest lichid consta în principal (?) din ele, atunci acest lucru ar trebui să afecteze greutatea specifică a apei, care nu a fost observată. Aceleași considerații se aplică și altor organisme. Prin urmare, trebuie să concluzionăm că particulele finale ale oricărui corp omogen sunt complet identice între ele în ceea ce privește greutatea, forma lor etc. Cu alte cuvinte, fiecare particulă de apă este identică cu orice altă particulă a acesteia, fiecare particulă de apă. hidrogenul este complet identic cu cealaltă particulă de hidrogen etc.". „Una dintre sarcinile principale ale acestei lucrări este de a indica importanța și beneficiul determinării greutății relative a particulelor finale, atât corpuri simple, cât și complexe, numărul de particule simple ale unui element care alcătuiesc o particulă complexă... Dacă sunt date două corpuri, AȘi b, predispuse la conectare, atunci sunt posibile următoarele combinații ale acestora, începând cu cea mai simplă, și anume:
1 atom de corp A+ 1 atom B= 1 atom CU, binar
1 atom A+ 2 atomi ÎN= 1 atom D, triplu
2 atomi A+ 1 atom B= 1 atom E, triplu
1 atom A+ 3 atomi ÎN= 1 atom F, cvadruplu
3 atomi A+ 1 atom ÎN= 1 atom g, cvadruplu
etc. Următoarele reguli generale pot fi luate ca linii directoare pentru investigațiile referitoare la sinteza chimică. 1) Dacă se poate obține un singur compus pentru două corpuri care reacționează, atunci trebuie să se presupune că este binar, cu excepția cazului în care un motiv ne obligă să se pronunțe în favoarea opiniei contrare. 2) Dacă se observă doi compuși (pentru 2 elemente), atunci trebuie să ne gândim că unul dintre ei este binar, iar celălalt este triplu. 3) Când se cunosc trei compuși, ar trebui să ne așteptăm ca unul dintre ei să fie binar și doi dintre ei să fie ternari. 4) Când se cunosc patru compuși, ar trebui să ne așteptăm ca unul dintre ei să fie binar, doi să fie ternari, unul cuaternar etc. 5) Un compus binar trebuie să fie întotdeauna mai greu specific decât un simplu amestec al ambelor corpuri constitutive. 6) Compusul triplu trebuie să fie mai specific decât un amestec dintr-un compus dublu cu unul simplu, care, combinat, ar putea forma un compus complex etc. 7) Regulile și observațiile indicate sunt de asemenea aplicabile atunci când corpuri precum CUȘi D, DȘi E... Din aplicarea acestor reguli, deducem următoarele concluzii: 1) că apa este un compus binar de hidrogen și oxigen, iar greutățile relative ale ambilor atomi elementari sunt de aproximativ 1:7; 2) că amoniacul este un compus binar de hidrogen și azot și că greutățile relative ale ambilor atomi elementari sunt aproximativ 1:5; 3) că oxidul de azot este un compus binar de azot și oxigen, a căror atomi cântăresc 5:7, respectiv ... În toate cazurile, greutățile sunt exprimate în atomi de hidrogen, fiecare dintre care este egal cu unul ... În Având în vedere noutatea, precum și importanța ideilor, s-a considerat oportun să se ofere tabele care ilustrează metoda de conectare în unele dintre cele mai cazuri simple... Elementele, sau atomii unor astfel de corpuri, care sunt considerate în prezent elementare, sunt indicate prin cercuri mici cu unele semne convenționale (vezi Formule); compusul constă în juxtapunerea a doi sau mai mulți atomi „... În prezent, totalul arbitrar al acestor reguli de ghidare este izbitor involuntar. Este evident că compoziția compusului nu depinde în niciun fel de faptul dacă știm, sau nu, condițiile pentru formarea a 2 elemente a mai multor compuși, iar dezacordul nostru în acest sens cu Dalton este cel mai bine ilustrat prin faptul că dăm formula H 2 O apei și H 3 N amoniacului, adică considerăm primul nu binar, dar corp triplu, iar al doilea - cvadruplu. Apoi, nu este clar de ce, având în vedere prezența a doi compuși, unul trebuie să fie binar, iar celălalt triplu; Până acum, doi compuși sunt cunoscuți cu certitudine pentru hidrogenul cu oxigen, dar acum considerăm că unul este triplu - H 2 O, iar celălalt cvadruplu - H 2 O 2 (peroxid de hidrogen). De asemenea, nu există nicio îndoială că poziția 5 este în dezacord puternic cu toate reacțiile de „substituție” și, de exemplu, cu reacția clasică de formare a clorurii de hidrogen:
H 2 + Cl 2 \u003d 2HCl,
când, după cum știți, ud. greutatea amestecului de hidrogen cu clor este, în limitele exactității observațiilor, sp. greutatea clorurii de hidrogen etc. Între timp, influența opiniilor lui Dalton asupra dezvoltării lui X. a fost enormă și continuă până în zilele noastre; Întrebarea este, ce a cauzat-o, când însăși ideea structurii atomice a materiei nu îi aparține lui Dalton? Din câte se poate aprecia, această influență se datorează următoarelor împrejurări: 1) Discontinuitatea materiei care ne înconjoară, lipsa de continuitate în ea, ne influențează atât de mult încât nu ne putem imagina în mod figurat că este continuă și toate încercările. în această direcție s-au dovedit până acum a fi neobișnuit de greu de înțeles și inutile; este evident că, din aceleași împrejurări, ideile atomice au apărut chiar și printre antici. 2) Dalton a arătat aplicabilitatea practică a vederilor atomice la chimie; acceptând că atomii diferitelor elemente diferă în greutate relativă [În acest sens, el a fost diferit de Higgins" (1790), care credea că atomii de bază sunt identici între ei și atribuie toate diferențele observate în materie mai mari sau mai mari. acumulări mai mici. Vederile lui Higgins „a au fost înviate mai întâi de către Praut” th, iar acum de J. J. Thomson ”th]; a dat o schemă neobișnuit de simplă și ușor accesibilă, în care existența atât a compușilor de compoziție constantă, cât și a compușilor supuși legii „raților multiple” se potrivește cu o ușurință surprinzătoare. Claritatea și aplicabilitatea schemei în ochii mai multor generații de chimiști au servit chiar drept „explicație” a acestor legi și abia acum se dovedește că „constanța compoziției” este posibilă mult mai des decât se credea anterior, că factorul ceea ce o determină este relația cunoscută dintre corpurile care reacţionează „naturii” încă nedeterminate, tipul de energie externă care acționează asupra sistemului și complexele fizice eterogene (fazele) din care este compus. Cât despre legea „raților multiple”, ea încă nu are o explicație general acceptată; comparația dată de Wald cu legea parametrilor raționali în cristalografie este nesatisfăcătoare din cauza vizibilității reduse și a insuficientei clarități a prevederilor principale; N. S. Kurnakov este de acord cu punctul de vedere al lui Wald în raportul său „Despre fuzibilitatea aliajelor metalice” la cel de-al XI-lea Congres Est. și vr. în Sankt Petersburg. în 1901; paralelismul ambelor propoziții cu greu poate fi pus la îndoială; dar, dacă în cristalografie legea menționată are chiar o demonstrație matematică, care pare să se bazeze pe imposibilitatea existenței cristalelor sferice, atunci încă nu este clar ce poziție paralelă ar trebui luată X. Pe de altă parte, Duhem spune: „Este evident că răspunsul (al teoriei atomice la fenomenele de raporturi multiple) este satisfăcător și poate fi considerat chiar o victorie pentru teoria atomică, o victorie cu atât mai vizibilă cu cât această explicație. a legii rapoartelor multiple nu a fost ajustată ulterior, care, dimpotrivă, are aceeași vârstă cu legea și poate a precedat descoperirea ei. Este această victorie definitivă? Pentru ca aceasta să fie așa, este necesar să nu doar că explicația rapoartelor multiple dată de teoria atomică să fie un curent probabil, dar și singurele posibile Dar cine va îndrăzni să-și asume garanția acestei interpretări și să îndrăznească să afirme că nu va fi niciodată posibil să găsească alta? Putem merge mai departe, dacă luăm în considerare cu ce ușurință, cu ce claritate se încadrează toate principiile lui X. modern într-o expunere din care nu numai cuvântul, ci și ideea însăși de atomi [Duhem se referă la expunerea dată. de el în lucrarea citată („Le mixte et la comb. chim.”, 1902).]; pe de altă parte, dacă acordăm atenție acelor contradicții care apar imediat de îndată ce explicăm aceste principii dintr-un punct atomic de vedere [Cf. Stallo, „La Mati ère et la Physique moderne”.], este greu de apărat de ideea că singurul succes al teoriei atomice reprezintă o victorie aparentă pentru care ziua de mâine nu este asigurată; că această teorie nu ne familiarizează cu adevărata cauză obiectivă a legii raporturilor multiple; că acest motiv trebuie încă descoperit și, în sfârșit, că X. modern nu vorbește în favoarea doctrinei lui Epicur. „Oricât ar răspunde viitorul, ideea este aceasta: Dalton a observat existența „relațiilor multiple” și a considerat că aceste fenomene decurg din reprezentările atomice, deoarece corespund celor mai simple combinații posibile de atomi; acum cunoaștem un număr imens de sisteme cu o compoziție nedefinită, și nu numai în stare gazoasă și lichidă, cum era cazul pe vremea lui Dalton, dar și în solid (începând cu amestecuri izomorfe Mitcherlich și terminând cu soluție solidă „t Hoff”); nu se poate spune că aceste fenomene contrazic direct structura atomică a materiei, dar pe de altă parte necesită o explicație de ce nu sunt observate în mod constant și este evident că nu ne mai putem liniști în această explicație despre „simplitate”. 3) În sfârșit, legea raporturilor multiple a lui Dalton le-a oferit chimiștilor un criteriu ușor accesibil pentru a judeca dacă au de-a face cu un singur corp individual sau cu un sistem complex format prin interacțiunea a două sau mai multe corpuri care sunt stabile în condiții experimentale. Această latură a subiectului nu a fost formulată clar de contemporani, dar importanța legii în sine nu le-a scăpat atenției, iar Thomson în curând (14 ianuarie 1808) constată că sarea acidă oxalic-potasică conține aproape dublul cantității de acid în comparație. la sarea medie, iar Wollaston descoperă (28 ianuarie 1808) rapoarte simple, multiple pentru unele săruri de acid, carbonic și oxalic, apoi Berzelius este luat pentru a determina greutățile atomice și le dedică câțiva ani de muncă grea și neobișnuit de atentă. [Cp. Ostwald "s, "Klassiker", nr. 35, "Versuch die bestimmten und einfachen Verhältnisse autzufinden, nach velchen die Bestandtheile der unorganischen Natur mit einander verbunden sind, von J. Berzelius" - 1818-19; Berzelius a dat apoi câteva articole suplimentare. ] Aici nu este locul să ne oprim asupra dificultăților pe care le-au întâmpinat chimiștii în stabilirea cu precizie a greutăților atomice și asupra modului în care regulile lui Dalton au fost eliminate treptat, iar Berzelius s-a bazat pe legile capacității termice a elementelor solide, Dulong și Petit, izomorfismul Mitcherlich (1819) ; ne mărginim să subliniem că toate acestea s-au dovedit a fi insuficiente, iar greutățile atomice moderne au fost stabilite abia după ce așa-numita „teorie moleculară” a lui Avogadro-Ampere a devenit general acceptată.
Legile volumetrice ale lui Gay-Lussac. Lavoisier (Oeuvres etc., I, 73 și 75) a observat că pentru ca oxigenul să se combine cu hidrogenul pentru a forma apă, este necesar să se ia de două ori volumul de hidrogen pe volum al acesteia; această împrejurare a fost contestată mai târziu (Dalton, de exemplu, a crezut că pentru 185 de ore de hidrogen ar trebui să existe 100 de volume de oxigen), și de aceea era important ca A.F. Humboldt și Gay-Lussac, cu experimente extrem de amănunțite pentru acea vreme, să stabilească [ „Exp ériences sur les moyens endiométriques et sur la proportion des principes constituants de l” atmosphè re”, 1805; vezi Ostwald, „Klassiker” No. 42.] că Lavoisier avea dreptate și că, într-adevăr, 200 rpm. hidrogenul este necesar pentru formarea apei 100 vol. oxigen. În acest moment, a existat deja o dispută între Proulx și Berthollet cu privire la constanța compoziției compușilor chimici, pe de altă parte, Dalton în „New System of chemical Philosophy” a vorbit în favoarea compoziției atomice invariabile a „chimic” compuși și, prin urmare, Gay-Lussac în 1808 (memoria „Sur la combinaison des substances gazeuses, les unes avec les autres” [Vezi Ostw. „Klas.” Nr. 42.] a întreprins un studiu lung asupra interacțiunii diferitelor gaze, rezultatele au fost favorabile opiniilor lui Proulx și Dalton, și anume, Gay-Lussac a constatat că „că combinațiile de corpuri gazoase între ele apar întotdeauna în rapoarte foarte simple, astfel încât 1, 2 și, cel mult, 3 volume din celălalt. sunt combinate cu un volum dintr-un gaz.Aceste raporturi de volum nu se observă pentru corpurile lichide și solide, ci egale cu felul, și pentru greutățile corpurilor care reacţionează, ceea ce constituie o nouă dovadă că numai în stare gazoasă corpurile sunt în aceeași circumstanțe și respectă legile corecte. Reducerea volumului suferită de gaze atunci când sunt combinate este, de asemenea, într-un raport simplu față de volumul unuia dintre ele, și aceasta este, de asemenea, caracteristică stării gazoase. De obicei, în manualele moderne, observațiile lui Gay-Lussac sunt rezumate sub forma a două legi: 1) Volumele corpurilor care reacţionează în stare de gaz şi vapori sunt fie egale, fie sunt în rapoarte simple exprimate prin rapoarte ale numerelor întregi mici simpleși 2) Volumul corpului format în stare de gaz și vapori este întotdeauna într-un raport simplu față de volum (gaz-vapori) a fiecăreia dintre părțile constitutive incluse în acesta. Experimentele lui Gay-Lussac par să fi pus capăt disputei lui Berthollet cu Proulx. Oricât de ciudat ar părea la prima vedere, Dalton a reacționat negativ la ele, și anume, pe lângă „Noul său sistem de filosofie chimică” el critică observațiile lui Gay-Lussac privind interacțiunea oxidului nitric și oxigenul (într-adevăr, eronate) și adaugă: „De fapt, ceea ce spune el despre volume este analog cu ceea ce spun eu despre atomi; și dacă s-ar putea dovedi că toate gazele (fluidele elastice) conțin volume egale număr egal atomi sau numere înrudite ca 1, 2, 3 etc., atunci ambele ipoteze ar coincide, cu excepția faptului că a mea este universală, iar a lui este aplicabilă numai gazelor. Gay-Lussac, totuși, nu a putut să nu vadă că o astfel de ipoteză a fost considerată de mine și respinsă ca nepotrivită [Dalton se referă la partea din cartea sa în care spune că a avut cândva o încredere vagă, pe care a împărtășit-o cu mulți alții, că în volume egale ale oricăror gaze (simple și complexe din punct de vedere chimic) există un număr egal de atomi, dar a trebuit să-l abandoneze, în primul rând, pe baza observațiilor privind interacțiunea oxigenului cu oxidul de azot, când un amestec de volume egale de gaze se reduce uneori la jumătate, ceea ce indică , că în corpul final sunt mai puțini atomi pe unitatea de volum decât în cei inițiali (această observație este incorectă), iar în al doilea rând, pentru că ud. greutatea vaporilor de apă este mai mică decât sp. greutatea oxigenului care o formează, ceea ce ar fi imposibil dacă s-ar forma prin combinarea a 2 atomi de hidrogen (2 vol.) cu 1 atom de oxigen (1 vol.), dar a reînviat această idee, și voi face o câteva lucruri despre el remarcă, deși nu am nicio îndoială că el însuși va vedea în curând inconsecvența părerii sale.” Dalton termină astfel: „Adevărul, sunt convins, este că gazele nu se combină niciodată în volume egale sau simple... ; nicăieri nu există o aproximare mai apropiată a acurateței matematice decât în cazul hidrogenului cu oxigen și, între timp, cel mai precis dintre experimentele mele arată: aici, la 1,97 vol. hidrogenul reprezintă 1 vol. Știm acum că Gay-Lussac a fost, fără îndoială, mai aproape de adevăr decât Dalton, și tocmai în cazul hidrogenului cu oxigen Morley și Scott au arătat că raportul adevărat era de 2,002 la 1.
Poziția Avogadro. În iunie 1811, fizicianul italian A. Avogadro s-a angajat să împace opiniile lui Dalton cu observațiile lui Gay-Lussac într-un articol intitulat: „Essai d” une mani ère de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon elles entrent. dans le s combinaison" [Nomenclatura pe care o urmează Avogardo în acest articol diferă de a noastră; după cum notează J. Walker, molecula lui = atom, moleculă (nu contează), molecule inté grante = moleculă (în primul rând corpuri complexe), mol é cule constituante - o moleculă a unui corp elementar și mol écule élé mentaire - un atom al unui corp elementar, dar unul dintre locurile din articol face să credem că mol écule inté grante înseamnă și un atom (cf. Ostwald "s ," Klassiker ", nr. 8).]. „Gay-Lussac a arătat într-un memoriu interesant”, scrie Avogadro, „că combinațiile de corpuri gazoase apar întotdeauna în rapoarte volumetrice foarte simple și că, în cazul unui produs de reacție gazoasă, volumul său este, de asemenea, în raporturi simple față de volume. a corpurilor care reacţionează.Dar raporturile dintre constituenţii maselor dintr-un compus par să depindă doar de numărul relativ de molecule care reacţionează (şi masele acestora) şi de numărul de molecule complexe formate.De aceea, trebuie concluzionat că există foarte multe relații simple între volumele corpurilor gazoase și numărul de molecule care le compun. , aparent, singura ipoteză acceptabilă ar trebui recunoscută că numărul de molecule ale oricăror gaze este același în volume egale, sau este întotdeauna proporțional cu volumul. , dacă numărul de molecule în volume egale a fost diferit pentru diferite gaze, atunci este greu de înțeles că legea care guvernează distanța moleculelor duce în toate cazurile la o legătură atât de simplă precum cea de mai sus, pe care suntem nevoiți să o recunoaștem între volum și numărul de molecule... Pe baza acestei ipoteze, se pare că avem un mijloc de a determina cu ușurință masele relative de molecule pentru corpurile capabile să existe în stare gazoasă, precum și numărul relativ de molecule necesare pentru reacţie; și anume, rapoartele maselor moleculelor din această ipoteză sunt aceleași cu rapoartele dintre gravitație specifică gaze diferite (la temperaturi și presiuni egale), iar numărul relativ de molecule care reacţionează este dat direct de raportul dintre volumele de gaze care se formează acest compus. De exemplu, deoarece numerele 1,10359 și 0,07321 exprimă greutatea specifică a gazelor de oxigen și hidrogen (greutatea unui volum egal de aer \u003d greutăți specifice unității [Aceste numere sunt incorecte.], apoi raportul lor, în caz contrar, raportul între masele de volum egal ale ambelor gaze, reprezintă, conform ipotezei noastre, raportul dintre masele moleculelor acestora, din care rezultă că molecula de oxigen este de aproape 15 ori mai grea decât molecula de hidrogen, sau, mai precis, sunt raportat ca 15,074 la 1 ... [Raportul dat aici este incorect (vezi formulele Pentru a înțelege raționamentul lui Avogadro, notăm greutatea moleculei de oxigen ca M, greutatea unei molecule de hidrogen prin 1, apoi greutatea unui anumit volum de oxigen va fi - xM, Unde X numărul de molecule de oxigen din acest volum și greutatea aceluiași volum de hidrogen = x 1(după poziție). Cunoscut ud. greutățile ambelor gaze în raport cu la aer, adică valorile: (xM)/pȘi (x 1)/p, Unde R - greutatea unui volum egal de aer; este evident că [(xM)/p]:[(x 1)/p] = M/1, adică egal cu raportul dintre greutățile moleculelor de oxigen și hidrogen, dintre care acesta din urmă este luat ca unitate de măsură convențională.]. Pe de altă parte, deoarece știm că raportul dintre volumele de hidrogen și oxigen în timpul formării apei = 2:1, atunci, prin urmare, știm că apa se formează în timpul interacțiunii fiecărei molecule de oxigen cu două molecule de hidrogen. .. Dar există un argument, care, la prima vedere, vorbește împotriva presupunerii ipotezei noastre pentru corpurile complexe. Pare necesar ca o moleculă complexă formată prin interacțiunea a două sau mai multe molecule de corpuri simple să aibă o masă egală cu suma maselor acestor din urmă; sau în special, când un corp complex este obţinut prin interacţiunea a 1 mol. un corp cu 2 sau mai mulți moli. alt corp la numărul de mol complexe. a rămas egal cu numărul de primul corp. În limbajul ipotezei noastre, acest lucru este echivalent cu faptul că, atunci când un gaz este combinat cu două sau mai multe volume dintr-un alt gaz, volumul compusului în stare gazoasă trebuie să fie egal cu volumul primului gaz. Și totuși, într-un număr mare de cazuri, acest lucru nu este observat. De exemplu, volumul de apă în stare gazoasă, așa cum arată Gay-Lussac, este de două ori volumul de oxigen folosit pentru a o forma sau, ceea ce este același, egal cu volumul de hidrogen, în loc să fie egal cu volumul de oxigen. Dar se prezintă și modul de interpretare a acestor fapte în conformitate cu ipoteza noastră; și anume, presupunem: 1) că moleculele oricăror corpuri elementare... nu sunt formate din molecule elementare separate (atomi), ci sunt compuse dintr-un anumit număr dintre ele, conectate prin atracție reciprocă între ele și 2) că atunci când moleculele altui corp sunt combinate cu moleculele primului, formând o moleculă complexă, apoi molecula integrală, care ar trebui să fie formată, se descompune în două sau mai multe părți, formate din jumătate, un sfert etc. din numărul de molecule de primul corp intrând în combinație, legat de o jumătate, un sfert din moleculele celui de-al doilea corp..., astfel încât numărul de molecule finale devine dublu, cvadruplu etc., în comparație cu ceea ce ar fi fără dezintegrare, și exact așa cum este cerut de raportul de volum observat al gazului rezultat [„Astfel, de exemplu, molecula finală de apă trebuie să fie compusă dintr-o jumătate de moleculă de oxigen combinată cu o moleculă sau două jumătate de molecule de hidrogen. " (aprox. Avogadro). Actul de conectare 2 despre. hidrogen cu 1 vol. oxigenul Avogadro își imaginează, în continuare, ca un compus 2x ei spun hidrogen din 1 x ei spun oxigenul să se formeze inițial 1x mol complex. apă conţinând fiecare câte 2 mol. hidrogen și 1 mol. oxigen, dar apoi se descompune în 2x digurile mai simple, a căror masă este deja
(2x mol. hidrogen + x mol. acid) / 2x = (2 mol. hidrogen) / 2 + (mol. acru) / 2 = mol. hidrogen. + (mol. acru)/2;
fiecare volum de vapori de apă conține de 2 ori mai puțin oxigen decât un volum egal de oxigen gazos, în acesta din urmă a fost X ei spun acru și un volum egal de abur conține
x mol. apă \u003d x (mol. hidrogen + mol. acid / 2).].
Trecând în revistă diferiții, cei mai bine studiati, compuși gazoși, găsesc doar exemple de dublare a volumului unuia dintre termeni, conectarea cu două sau mai multe volume ale altui corp [Expresia este incorectă, dar, din păcate, des folosită. Fără îndoială, aici nu se observă o dublare a volumului, dimpotrivă, are loc reducerea acestuia; Avogadro, pe de altă parte, vorbește despre dublare, deoarece, conform presupunerii sale, volumul corpurilor care reacţionează este iniţial redus la un volum. În prezent, pot fi date exemple mult mai complexe și ecuația pentru formarea hidrogenului sulfurat la o temperatură. sulf la fierbere:
S 8 + 8H 2 \u003d 8SH 2
Avogadro ar fi trebuit să se explice prin formarea moleculei inițial complexe S 8 Η 16 și octalizarea ulterioară a volumului său: S 8 H 16 \u003d 8SH 2 .]. Am văzut deja asta pentru apă. În mod similar, știm că volumul de amoniac este de două ori mai mare decât volumul de azot (liber) din acesta. Dar este posibil ca în alte cazuri moleculele să fie împărțite în 4, 8 etc. Posibilitatea unei astfel de împărțiri ar trebui așteptată și a priori... volume și neschimbate, mai mult, ca, de exemplu, în cazul de oxid nitric [Compoziție și sp. greutatea oxidului de azot este dată în formula NO, a cărui formare din azot și oxigen poate fi reprezentată doar prin ecuație
N 2 + O 2 \u003d 2NO.
De fapt, această reacție nu a fost încă realizată. Exemple bune sunt reacțiile:
H 2 + Cl 2 \u003d 2HCl,
H 2 + Br 2 \u003d 2HBr,
care apar fără modificarea volumului.]. Cu ipoteza divizibilității moleculelor, este ușor de observat că combinația transformă de fapt două tipuri de molecule într-una singură și că o reducere cu cel puțin volumul unuia dintre gaze ar trebui să aștepte dacă fiecare moleculă complexă (vezi nota de mai sus) nu era divizibil în alte două, de natură identică... Pe baza unor presupuneri arbitrare despre cel mai probabil număr de molecule (atomi) din compuși, Dalton a încercat să stabilească relații între moleculele corpurilor simple. Ipoteza noastră... face posibilă corectarea datelor sale... Astfel, de exemplu, Dalton presupune că apa se formează prin combinarea hidrogenului și oxigenului moleculă cu moleculă (atom cu atom). Pe baza acestui fapt, și pe baza greutăților relative ale ambelor corpuri conținute în apă, rezultă că masa moleculei de oxigen trebuie să fie raportată la masa moleculei de hidrogen ca aproximativ 7½ la 1 sau, conform Dalton însuși, ca 6 la 1. Conform ipotezei noastre, acest raport este doar de două ori mai mare, și anume = 15:1. În ceea ce privește molecula de apă, ar trebui să fie egală în numere rotunde 15 + 2 = 17 (luând molecula de hidrogen ca 1) dacă nu ar fi divizibil cu 2; dar în virtutea acestei împărțiri, devine jumătate, adică 8½, sau, mai precis, 8.537, cât se poate găsi direct prin împărțirea bătăilor. greutatea vaporilor de apă, adică 0,625 (Gay-Lussac; greutatea specifică este dată în raport cu aerul) per sp. greutatea hidrogenului este de 0,0732. Această masă diferă de cele 7 atribuite de Dalton moleculei de apă, doar din cauza diferenței de numere pentru compoziția apei adoptate de Dalton etc. Faptul că opiniile lui Avogadro au fost puțin apreciate de contemporanii săi nu este surprinzător.Dalton nu a putut fi de acord. cu ei pentru că, în general, se îndoia de corectitudinea observațiilor lui Gay-Lussac și, în plus, părerile lui Avogadro au fost împotriva convingerilor sale despre indivizibilitatea atomilor; este mai ciudat că mai târziu articolul lui Avogadro a rămas complet uitat și că și acum se pot găsi multe neînțelegeri în manuale despre aceasta Trebuie să se vadă clar că propoziția lui Avogadro: „Volume egale ale oricăror gaze la temperaturi și presiuni egale conțin un număr egal de molecule” sau invers: „Un număr egal de molecule de gaze luate la temperaturi și presiuni egale corespunde. la volume egale”, reprezintă, strict vorbind, nu o „ipoteză”, ci o definiție pur condiționată și nimic mai mult [Ostwald în „Grundlinien” al său îl numește postulatul lui Avogadro.]; acceptând-o, suntem de acord să descriem compușii noștri în așa fel încât reacțiile lor să se supună legilor lui Gay-Lussac, adică adică, astfel încât fiecare formulă să corespundă în stare gazoasă unui volum normal convențional în condiții normale și este clar că putem exprima astfel toate transformările cu care se ocupă X., deoarece toate sunt de imaginat ca având loc în stare gazoasă; că formulele noastre sunt de acord cu realitatea nu numai la temperatura și presiunea experienței, ci și la altele - rezultă pur și simplu din aplicabilitatea relativ largă a legilor lui Boyle-Mariotte și Charles-Gay-Lussac (vezi Gaze). Când datele experimentale despre beat. greutățile unui vapor dat nu sunt de acord cu formula pe care o așteptăm, atunci de obicei căutăm o astfel de temperatură și o astfel de presiune la care se observă un astfel de acord sau lăsăm complet deoparte datele experimentale și scriem formule „moleculare” care nu corespund „legii” lui Avogadro; deci, în orice X. organic puteți găsi că molecula de acid acetic. are formula: C 2 H 3 O (OH), că existența a 3 atomi de hidrogen în acidul acetic, nu sub formă de reziduu apos, reiese clar din faptul că, atunci când acidul este tratat cu clor, putem înlocuiți succesiv 1/3, 2/3 și, în final, 3/3, adică tot hidrogenul este clor; între timp, nu există nicio îndoială că la o temperatură. fierbere, formula vaporilor de acid acetic corespunde îndeaproape - C 4 H 8 O 4, iar formula acidului monocloroacetic este mai apropiată de C 4 H 6 Cl 2 O 4 decât de C 2 H 3 ClO 2. Mai multe astfel de exemple ar putea fi citate, dar chiar și cel citat deja arată destul de clar că nu avem de-a face cu „legea lui Avogadro”, adică nu cu un asemenea raport numeric, care este obiectiv și care nu depinde de arbitrariul nostru, ci cu un mod de exprimare, calcul al datelor experimentale. Este posibil ca numar real moleculele conținute într-un anumit volum de gaz (cu excepția cazului în care moleculele reprezintă ficțiunea noastră) nu are nimic de-a face cu numărul de molecule stabilit prin propoziția lui Avogadro și este de imaginat ca în volume egale de două gaze (la temperaturi și presiuni egale) să fie cuprinse de fapt, un număr complet diferit dintre ele [Deoarece legea lui Boyle și Charles - PV = RT nu este exactă din punct de vedere matematic, atunci, chiar și luând în considerare poziția lui Avogadro ca fiind strict în concordanță cu realitatea, trebuie să admitem că egalitatea matematică a moleculelor în volume egale a două gaze este posibilă numai la un anumit punct de temperatură specific și la o anumită presiune specifică (sau cu unele raporturi specifice şi artificiale între masele de gaze şi volumele ocupate de acestea).]; Legile lui Gay-Lussac, care se regăsesc empiric și sunt complet independente de ideile noastre despre structura materiei, o astfel de presupunere nu le va afecta câtuși de puțin: vor rămâne la fel de inexplicabile precum „legea raporturilor multiple”, pe care o reprezintă pt. corpuri gazoase, este inexplicabilă. Este foarte regretabil pentru că în unele manuale X. se găsește o demonstrație matematică a exactității „legii”, și mai mult, demonstrația inițiată de Maxwell („Theor y of Heat”, L., 1894, 325; „Law a lui Gay-Lussac"). „Luați în considerare”, spune el, „cazul în care două gaze sunt în echilibru termic. Am arătat deja că dacă Μ 1 și M 2 reprezintă masele moleculelor individuale ale acestor gaze, a V 1, și V 2 viteze de agitare corespunzatoare acestora, este necesar ca, conform ecuatiei (1), la echilibru termic
M 1 V 1 2 = M 2 V 2 2 .
Dacă presiunile ambelor gaze p 1 și p 2 și numărul de molecule pe unitate de volum N 1 și N2, apoi conform ecuației (2)
p 1 = 1/3 M 1 N 1 V 1 2
R 2 = 1/3 M 2 N 2 V 2 2 ;
dacă presiunile sunt egale, atunci
M 1 N 1 V 1 2 \u003d M 2 N 2 V 2 2,
iar dacă temperaturile sunt egale, atunci
M 1 V 1 2 = M 2 V 2 2 ;
împărțind ultimele două ecuații termen cu termen, aflăm că Ν 1 = N 2(6), sau că atunci când două gaze sunt la aceeași temperatură și aceeași presiune, atunci numărul de molecule pe unitatea de volum este același pentru ambele gaze. „Se pare evident pentru scriitor că, chiar dacă presiunile a două gaze diferite. sunt egale, , care sunt la echilibru termic, expresiile pentru R 1 Și R 2 nu poate fi echivalat până când nu s-a dovedit că aceasta trebuie să implice volume egale ale ambelor gaze; acest lucru este presupus de Maxwell, deoarece N 1 și N 2 se referă la ele ca „unități de volum”, dar necesitatea unei astfel de presupuneri nu poate fi considerată evidentă, deoarece presiunea gazului, odată stabilită, nu are nicio legătură cu volumul ocupat de gaz. Datorită acestei alegeri arbitrare, însăși sarcina nedeterminată a dobândit decizie hotărâtă. Clausius (1857) a fost mai precaut în această privință; a presupus că în volume egale de gaze există un număr egal de molecule și deja din aceasta a dedus cu ajutorul teoriei cinetice a gazelor că și forțele lor vii trebuie să fie egale. Astfel, nu putem avea o dovadă a propoziției lui Avogadro, dar este cert că odată ce vom accepta definiția sa, vom putea stabili cu ușurință greutățile relative ale moleculelor (greutățile relative ale volumelor egale de gaze); totul se rezumă la două definiții ale bătăilor. greutățile gazelor comparate și, așa cum am văzut mai sus, este complet indiferent în raport cu ce gaz sp. greutate. Avogadro a considerat molecula de hidrogen ca fiind unitatea de greutate moleculară (vezi mai sus); acum foarte adesea o astfel de unitate este considerată a fi un atom de hidrogen. Următoarea întrebare este câți atomi de hidrogen sunt în molecula sa și ce definiție a cuvântului „atom” poate fi dată, urmând terminologia lui Avogadro. Din experiență s-a constatat că în timpul interacțiunii chimice a corpurilor gazoase, adesea unul dintre ele după transformare este într-un volum mai mare decât înainte de experiment; deci, de exemplu, s-a indicat mai sus că o masă dată de oxigen sub formă de vapori de apă ocupă de două ori volumul decât aceeași masă de oxigen pur luată în aceleași condiții de temperatură și presiune; împreună cu Avogadro exprimăm acest lucru spunând că în formarea apei molecula de oxigen este împărțită în două jumătăți absolut identice și, prin urmare, admitem că reacții chimice poate fi însoțită de divizarea moleculelor; experiența arată, de altfel, că această împărțire merge adesea atât de departe încât ne este inaccesibilă în orice alt mod; deci, de exemplu, dacă rămânem cu exemplul tocmai menționat, indiferent cât de ridicate am compara temperaturile vaporii de apă cu oxigenul, va exista întotdeauna de două ori mai mult oxigen într-un anumit volum de oxigen gazos decât va conține într-un volum egal de oxigen. vapor de apă. Pe de altă parte, cuvântul „atom”, derivat din gr. sl. άτομος - indivizibil, ne obligă să desemnăm prin el o astfel de masă de materie pe care să o recunoaștem ca fiind incapabilă de simplificare ulterioară prin divizare. De aici definiția modernă a unui atom: este - cea mai mică masă a unui element dat cu care acesta intră în compoziția moleculelor complexe din punct de vedere chimic, adică moleculele unor astfel de corpuri în care, pe lângă acest element, există cel puțin un alt element. Pentru a rezolva întrebarea de mai sus, este necesar, în continuare, să se determine ud-ul. greutățile hidrogenului diverșilor compuși cu hidrogen, se determină prin analiză ce proporție dintre acești sp. greutățile, exprimate în molecule de hidrogen, cad pe hidrogen și o iau pe cea mai mică pentru atomul său; conform legii Gay-Lussac, raportul dintre masa găsită și masa moleculei de hidrogen trebuie exprimat ca un întreg simplu, adică relativ mic. Puteți face altfel; se pot compara volumele de compuși gazoși cu volumul de hidrogen conținut în ei; raportul, exprimat ca cel mai mare număr întreg, ne oferă o măsură a divizibilității moleculei de hidrogen. Pentru clarificare, să luăm, ca exemple, compușii de hidrogen: gazul de mlaștină (un compus de carbon și hidrogen), amoniacul (un compus de azot și hidrogen), apa (un compus de oxigen și hidrogen) și clorură de hidrogen (compoziția elementară este dat de numele însuși); bate greutatea hidrogenului primului = 8, adică greutatea X ei spun gaz de mlaștină: greutate X ei spun hidrogen \u003d 8, de unde se spune. gaz de mlaștină = în greutate 8 mol. hidrogen; analiza arată că ¼ din această cantitate cade pe hidrogen, apoi, mol. gazul de mlaștină este format din carbon (cu o greutate de 6 moli hidrogen) și 2 moli. hidrogen; bate greutatea amoniacului = 8½ și 1½, greutate. unitati din această cantitate se încadrează în ponderea hidrogenului; în continuare, argumentând în modul precedent, ajungem la concluzia că 1 mol. amoniacul constă din azot (cu greutatea de 7 mol. hidrogen) și 1½ = 3/2 mol. hidrogen; compoziția moleculei de apă este oxigen (în cantitate = 8 mol. hidrogen) și 1 mol. hidrogen; în cele din urmă, ud. greutatea acidului clorhidric = 18,25, din care doar 0,5 este hidrogen; în continuare, molecula de acid clorhidric constă din clor (= 17,75 mol. hidrogen) și ½ mol. hidrogen; ultima valoare este cea mai mică dintre cele găsite de noi; în consecință, putem presupune că molecula de hidrogen este divizibilă în jumătate, iar această jumătate poate fi luată provizoriu drept „greutatea atomică” a hidrogenului. De înțeles, luarea în considerare a acestor compuși din perspectiva compoziției lor în vrac duce, de asemenea, la aceeași concluzie; cifrele date mai sus spun exact că 1 vol. gazul de mlaștină este egal cu ½ vol. hidrogenul din el, 1 vol. amoniac = 2/3 vol. hidrogen conținut în el, 1 vol. vapori de apă = 1 vol. hidrogen, disponibil în el și, în final, 1 vol. clorura de hidrogen este de două ori volumul hidrogenului din ea; cea mai mare creștere a avut loc în formarea clorurii de hidrogen și, conform lui Avogadro, trebuie să recunoaștem că molecula de hidrogen este divizibilă în jumătate. Numeroase determinări ale compoziției unei mari varietăți de compuși au arătat că nu există compuși complecși chimic în molecula cărora ar fi mai puțin de jumătate de moleculă de hidrogen; putem, așadar, să numim în sfârșit această cantitate atomul de hidrogen [Comparați, totuși, experimentele lui J. J. Thomson.] și, notând-o cu litera h, scrie molecula de hidrogen H 2 . Pentru a găsi ud. greutatea gazului în raport cu hidrogenul, trebuie să luăm raportul dintre greutățile volumelor egale de gaz și hidrogen (la o anumită temperatură și presiune), conținând, prin definiție, un număr egal de molecule și deci acest sp. greutate
D \u003d (xM) / (xH 2),
Unde X- necunoscut numărul de molecule ale ambelor gaze, M este greutatea unei molecule de gaz date și H 2 - greutatea unei molecule de hidrogen, sau cu cuvinte: greutatea moleculară a unui gaz este D odată luată greutatea moleculară a hidrogenului; când îl exprimăm în atomi de hidrogen (în jumătăți dintr-o moleculă de hidrogen), atunci este egal cu 2D ori mai mare decât greutatea atomică a hidrogenului. De obicei, aceasta din urmă este luată ca unitate de măsură; Apoi
M=2D,
dar trebuie amintit că în această expresie D este un număr abstract și se numește 2, deoarece stă în loc de 2 atomi de hidrogen și s-a indicat deja mai devreme (vezi Formulele) că, în cazul în care luăm în considerare oxigen = 16, atunci greutatea atomică a hidrogenului \u003d 1.008, și așa mai departe., Apoi
M" \u003d 2 1.008D,
Unde M" reprezintă o formulă în care toate greutățile atomice sunt raportate la O = 16, a D bate greutatea aburului (gazului) prin hidrogen. Despre volumul moleculelor gram la H 2 = 2 și O 2 = 32 - vezi Formulele chimice. În concluzie, trebuie subliniat că, pe lângă Avogadro, au scris despre aceeași problemă: Ampère („Ann. de chim.” 90, 1814, traducere germană, în „Klassik.”, nr. 8) de Ostwald, Godin (Gandin, „Ann. chim. phys.”, 35, 1833: „Recherches sur la structure intime dos corps inorganiques d é finis etc.” volume egale de gaze în pătrate egale - un dispozitiv mnemonic pe care Hoffmann l-a introdus ulterior.], Gerard (vezi Sistemul unitar) și, mai ales, Cannizzaro (Sf. Cannizzaro, „Nuovo Cimento”, 7, 1858: „Sunto di un corso di filosofi a chimica fatto nella Reale Universita di Genova”; în germană în „Klassiker” de Ostwald, nr. 30), care a redescoperit Avogadro. Toate obiecțiile la „lege, Avogadro” nu pot fi enumerate nici măcar aici. Este suficient, ca exemplu de neînțelegeri, să indice că greutatea specifică a vaporilor de amoniac în raport cu hidrogenul sa dovedit a fi să fie egală nu cu jumătate din formulă, ci cu un sfert din aceasta, adică
NH 4 Cl / 4 \u003d NH 4 Cl / 2H 2,
de unde a rezultat că molecula de hidrogen corespunde
NH4CI/2 \u003d N/2 + H4/2 + CI/2;
întrucât în condițiile evaporării NH 4 Cl era imposibil să se permită divizarea „atomilor” de azot și clor, adică modificări ale acestor elemente, G. St. Clair Deville a considerat densitatea anormală a vaporilor de NH 4 Cl ca fiind dovezi ale inexactității „legii lui Avogadro”. S. Cannizzaro cel dintâi [Cf. E. Mitscherlich, „Ueber das Verh ältniss des spec. Gewichts de r Gasarten zu den chem. Proportionen”, „Ann. Ch. Ph.”, 12, 1834 și „Gesamm. Abhandl.”.] a indicat că dezacordul ar putea fi explicat prin dezintegrarea NH 4 Cl în NH 3 şi HCl, care ar trebui să ocupe volumul a 2 „molecule” de hidrogen. Experiența directă a lui Pebal a confirmat ulterior această considerație. Trebuie remarcat faptul că în multe cazuri de bătăi anormale. Nu există încă un studiu experimental al produselor rezultate și, prin urmare, este posibil ca interpretarea acceptată acum să se dovedească mai târziu a fi incorectă. Deci, de exemplu, o scădere cu creșterea temperaturii sp. greutatea unei perechi de acid acetic, ajungând la C 4 H 8 O 4 /2H 2, se explică de obicei prin expresia:
dar este posibilă următoarea reacție:
(anhidridă acetică) + H 2 O, etc. Toate greutățile atomice moderne sunt derivate în conformitate cu definiția lui Avogadro și, prin urmare, toate substanțele chimice moderne. echivalentul (în special pentru corpurile gazoase) poate servi ca ilustrații ale legilor volumetrice ale lui Gay-Lussac.
Alte legi care servesc la determinarea greutăților moleculelor, atomilor și echivalenților. Nu toți compușii și elementele sunt capabili să treacă în stare gazoasă. Suntem lipsiți de posibilitatea în astfel de cazuri de a stabili greutatea relativă a moleculei în bătăi. greutatea vaporilor (vezi Determinarea densității vaporilor) și, prin urmare, nu putem determina direct greutatea atomică (cea mai mică) cu care un anumit element face parte din moleculele acestor corpuri. Ultima valoare poate fi, totuși, stabilită indirect în astfel de cazuri, folosind unele proprietăți ale soluțiilor (vezi Soluții, Crioscopie și Ebulioskopiya) sau pe baza izomorfismului (vezi); putem stabili valoarea greutății atomice folosind legea lui Dulong și Petit sau legea periodică a lui D. I. Mendeleev (vezi Legea periodică și Greutățile atomilor); în cele din urmă, valoarea echivalentului poate fi stabilită folosind legea electrolitică a lui Faraday (vezi Electroliza și disocierea electrolitică). - Despre legile cantitative care guvernează transformările chimice, legea acțiunii masei și legea fan "t Hoff - vezi Afinitatea chimică, Echilibrul chimic, Reversibilitatea reacțiilor chimice.
Istoria dezvoltării vederilor chimice, pe lângă acest articol, a fost atinsă în mod repetat în acest Dicționar. Vezi: Alchimie, Substanță, Aer, Greutăți ale atomilor, Glicoli, Glicerină, Dualism, Substituție, Izomerie, Acizi, Metale și metaloizi, Acid lactic, Reversibilitate chimică. Reacții, Parafine, Legea periodică a elementelor chimice, Limita acizilor organici, Pseudomerism, Radicali, Sare, Stereochimie, Termochimie, Acid acetic. (structură), Sistem unitar, Flogiston, Formule chimice, Nomenclatură chimică, Structura chimică, Afinitate chimică, Teoria tipurilor chimice, Electrochimie, Electroliză, Disocierea electrolitică, Etil, Teoria eterenei, Teoria nucleară și biografiile tuturor chimiștilor de seamă. Istoric informații despre elemente și compuși chimici principali - vezi articolele speciale dedicate acestora.
A. I. Gorbov. Δ.
Dicționare în limba rusă
Cunoașteți deja simbolurile unor elemente chimice.
Ce arată simbolul chimic?
1) Indică un element chimic (dați un nume);
2) un atom al acestui element;
3) prin simbol, puteți determina locul elementului în sistem periodic DI. Mendeleev;
4) sistemul periodic poate fi folosit pentru a determina masa atomică relativă a unui element.
Să luăm un exemplu.
Simbol element chimic - Cu
1) Elementul chimic este cuprul.
2) un atom de cupru;
3) Cuprul este în sistemul periodic de elemente din perioada 4, grupa 1, număr de serie - 29.
4) Ar(Cu)=64
Să rezumăm informațiile pe care le cunoaștem, care conțin o formulă chimică.
Masa. Informații conținute într-o formulă chimică.
Exemplu: HNO3 - acid azotic
| 1. Compoziția calitativă | 1. O moleculă este formată din atomi a trei elemente chimice: H, N, O |
| 2. Compoziția cantitativă | 2. Molecula este formată din cinci atomi: un atom de hidrogen, un atom de azot, trei atomi de oxigen |
| 3. Greutatea moleculară relativă | 3.Mr(HNO3)= 1 1+14 1+16 3=63 |
| 4. Masa moleculei | 4. mm(HNO3)= 1a.u.m. 1+ 14 amu 1+ 16 amu 3=63 amu |
| 5. Fracții de masă ale elementelor | 5.ω(H) = Ar(H) 1 / Mr(HNO3)= 1 1/63=0,016 sau 1,6% ω(N)= Ar(N)1 /Mr(HNO3)= ω(O)= Ar(O)3 /Mr(HNO3)= |
Finalizați sarcina din registrul de lucru prin analogie
Rezumând
Felicitări, ai trecut testul până la capăt!
Acum faceți clic pe butonul Trimiteți testul pentru a vă salva permanent răspunsurile și pentru a obține o notă.
Atenţie! După ce faceți clic pe butonul, nu veți putea face modificări.
Decizia privind necesitatea menținerii unui astfel de caiet nu a venit imediat, ci treptat, odată cu acumularea experienței de muncă.
La început a fost un loc la sfârșitul registrului de lucru - câteva pagini pentru a scrie cele mai importante definiții. Apoi cele mai importante mese au fost amplasate acolo. Apoi a venit conștientizarea că, pentru a învăța cum să rezolve probleme, majoritatea studenților au nevoie de prescripții algoritmice stricte, pe care ei, în primul rând, trebuie să le înțeleagă și să le amintească.
Atunci s-a luat decizia de a menține, pe lângă carnetul de muncă, un alt caiet de chimie obligatoriu - un dicționar de chimie. Spre deosebire de caietele de lucru, care pot fi chiar două pe parcursul unui an universitar, dicționarul este un singur caiet pentru întregul curs de chimie. Cel mai bine este ca acest notebook să aibă 48 de coli și o copertă puternică.
Aranjam materialul din acest caiet astfel: la început - cele mai importante definiții pe care băieții le notează din manual sau le notează sub dictarea profesorului. De exemplu, la prima lecție din clasa a VIII-a, aceasta este definiția materiei „chimie”, conceptul de „reacții chimice”. Pe parcursul anului școlar în clasa a VIII-a acumulează mai mult de treizeci. Conform acestor definiții, fac sondaje în cadrul unor lecții. De exemplu, o întrebare orală în lanț, când un elev îi pune o întrebare altuia, dacă a răspuns corect, atunci el pune deja următoarea întrebare; sau, atunci când unui elev i se pun întrebări de către alți elevi, dacă el nu face față răspunsului, atunci ei își răspund singuri. În chimia organică, acestea sunt în principal definiții de clasă materie organicăși conceptele principale, de exemplu, „omologi”, „izomeri”, etc.
La sfârșitul cărții noastre de referință, materialul este prezentat sub formă de tabele și diagrame. Pe ultima pagină se află chiar primul tabel „Elemente chimice. Semne chimice”. Apoi tabelele „Valență”, „Acizi”, „Indicatori”, „Serii electrochimice de tensiuni ale metalelor”, „Serii de electronegativitate”.
Vreau în special să mă opresc asupra conținutului tabelului „Correspondența acizilor cu oxizii acizi”:
| Corespondența acizilor cu oxizii acizi | ||||
| oxid acid | Acid | |||
| Nume | Formulă | Nume | Formulă | Reziduu acid, valență |
| monoxid de carbon (II) | CO2 | cărbune | H2CO3 | CO 3 (II) |
| oxid de sulf(IV). | SO2 | sulfuros | H2SO3 | SO3(II) |
| oxid de sulf(VI). | SO 3 | sulfuric | H2SO4 | SO4(II) |
| oxid de siliciu (IV). | SiO2 | siliciu | H2SiO3 | SiO 3 (II) |
| oxid nitric (V) | N2O5 | azotic | HNO3 | NR 3 (I) |
| oxid de fosfor (V). | P2O5 | fosforic | H3PO4 | PO 4 (III) |
Fără înțelegerea și memorarea acestui tabel, este dificil pentru elevii din clasa a VIII-a să alcătuiască ecuații de reacție oxizi acizi cu alcalii.
Când studiem teoria disociației electrolitice, la sfârșitul caietului notăm scheme și reguli.
Reguli pentru compilarea ecuațiilor ionice:
1. Sub formă de ioni, notați formulele electroliților puternici care sunt solubili în apă.
2. În formă moleculară, notează formulele substanțelor simple, oxizilor, electroliților slabi și tuturor substanțelor insolubile.
3. Formulele substanțelor slab solubile din partea stângă a ecuației sunt scrise în formă ionică, în dreapta - în formă moleculară.
Când studiem chimia organică, scriem în dicționar tabele rezumative pentru hidrocarburi, clase de substanțe care conțin oxigen și azot, scheme pentru relațiile genetice.
| Mărimi fizice | |||
| Desemnare | Nume | Unități | Formule |
| cantitate de substanță | cârtiță | = N / N A ; = m / M; V / V m (pentru gaze) |
|
| N / A | constanta lui Avogadro | molecule, atomi și alte particule | NA = 6,02 10 23 |
| N | numărul de particule | molecule, atomi și alte particule |
N = N A |
| M | Masă molară | g/mol, kg/kmol | M = m/; / M/ = M r |
| m | greutate | g, kg | m = M; m = V |
| Vm | volumul molar gaz | l/mol, m3/kmol | Vm \u003d 22,4 l / mol \u003d 22,4 m 3 / kmol |
| V | volum | l, m 3 | V = V m (pentru gaze) ; |
| densitate | g/ml; | = m/V; M / V m (pentru gaze) |
|
În cei 25 de ani de predare a chimiei la școală, a trebuit să lucrez la diferite programe și manuale. În același timp, a fost întotdeauna surprinzător că practic niciun manual nu învață cum să rezolvi problemele. La începutul studiului chimiei, pentru a sistematiza și consolida cunoștințele în dicționar, eu și studenții alcătuim un tabel „Mărimi fizice” cu mărimi noi:
Când îi învață pe elevi cum să rezolve probleme de calcul, mare importanță Dau algoritmi. Consider că prescrierea strictă a secvenței de acțiuni permite unui elev slab să înțeleagă soluția unor probleme de un anumit tip. Pentru studenții puternici, aceasta este o oportunitate de a atinge nivelul creativ al educației chimice ulterioare și al autoeducației, deoarece mai întâi trebuie să stăpâniți cu încredere un număr relativ mic de tehnici standard. Pe baza acestui fapt, se va dezvolta capacitatea de a le aplica corect în diferite etape ale rezolvării unor probleme mai complexe. Prin urmare, am compilat algoritmi pentru rezolvarea problemelor de calcul pentru toate tipurile de probleme curs şcolarși pentru activități extracurriculare.
Voi da exemple pentru unele dintre ele.
Algoritm pentru rezolvarea problemelor prin ecuații chimice.
1. Scrieți pe scurt starea problemei și faceți o ecuație chimică.
2. Deasupra formulelor din ecuația chimică, scrieți datele problemei, scrieți numărul de moli sub formule (determinat de coeficient).
3. Aflați cantitatea unei substanțe a cărei masă sau volum este dată în starea problemei, folosind formulele:
M/M; \u003d V / V m (pentru gaze V m \u003d 22,4 l / mol).
Scrieți numărul rezultat deasupra formulei din ecuație.
4. Aflați cantitatea dintr-o substanță a cărei masă sau volum este necunoscută. Pentru a face acest lucru, raționați conform ecuației: comparați numărul de moli în funcție de condiție cu numărul de moli conform ecuației. Proporționează dacă este necesar.
5. Aflați masa sau volumul folosind formulele: m = M ; V = V m .
Acest algoritm este baza pe care elevul trebuie să o stăpânească pentru ca pe viitor să poată rezolva probleme folosind ecuații cu diverse complicații.
Sarcini pentru exces și deficiență.
Dacă în starea problemei se cunosc simultan cantitățile, masele sau volumele a două substanțe care reacţionează, atunci aceasta este o problemă de exces și deficiență.
La rezolvare:
1. Este necesar să găsiți cantitățile a două substanțe care reacţionează după formulele:
M/M; = V/V m .
2. Numerele de moli rezultate sunt înscrise deasupra ecuației. Comparându-le cu numărul de moli conform ecuației, trageți o concluzie despre care substanță este dată în deficiență.
3. Prin deficiență, faceți calcule suplimentare.
Sarcini pentru ponderea randamentului produsului de reacție, obținut practic din teoretic posibil.
Conform ecuațiilor de reacție, se efectuează calcule teoretice și se găsesc date teoretice pentru produsul de reacție: teor. , m teor. sau V teor. . La efectuarea reacțiilor în laborator sau în industrie apar pierderi, deci datele practice obținute sunt practice. ,
m practic sau V practice. este întotdeauna mai mică decât datele calculate teoretic. Fracția de randament se notează cu litera (eta) și se calculează prin formulele:
(this) = practica. / theor. = m practic. / m teor. = V practic. / V teor.
Se exprimă ca fracție de unitate sau ca procent. Există trei tipuri de sarcini:
Dacă datele pentru substanța inițială și ponderea randamentului produsului de reacție sunt cunoscute în starea problemei, atunci trebuie să găsiți practic. , m practic sau V practice. produs de reacție.
Ordinea soluției:
1. Calculați conform ecuației, pe baza datelor pentru substanța originală, găsiți teoria. , m teor. sau V teor. produs de reacție;
2. Aflați masa sau volumul produsului de reacție, obținut practic, după formulele:
m practic = m teor. ; V practica. = V teor. ; practic = theor. .
Dacă în starea problemei sunt cunoscute datele pentru substanța și practica inițială. , m practic sau V practice. a produsului obţinut, în timp ce este necesar să se găsească ponderea randamentului produsului de reacţie.
Ordinea soluției:
1. Calculați conform ecuației, pe baza datelor pentru substanța inițială, găsiți
Theor. , m teor. sau V teor. produs de reacție.
2. Aflați ponderea randamentului produsului de reacție folosind formulele:
Prakt. / theor. = m practic. / m teor. = V practic. /V teor.
Dacă în starea problemei sunt cunoscute se practică. , m practic sau V practice. a produsului de reacție rezultat și a ponderii randamentului acestuia, în acest caz, trebuie să găsiți date pentru substanța inițială.
Ordinea soluției:
1. Găsiți teor., m teor. sau V teor. produs de reacție conform formulelor:
Theor. = practic / ; m teoretic. = m practic. / ; V teor. = V practic. / .
2. Calculați conform ecuației, pe baza teoriei. , m teor. sau V teor. produsul de reacție și găsiți date pentru materia primă.
Bineînțeles, luăm în considerare aceste trei tipuri de probleme treptat, dezvoltăm abilitățile de a rezolva fiecare dintre ele folosind exemplul unui număr de probleme.
Probleme la amestecuri și impurități.

O substanță pură este cea care este mai mult în amestec, restul sunt impurități. Denumiri: masa amestecului - m vezi, masa substanta pura- m q.v., masa impurităților - m aprox. , fracția de masă a unei substanțe pure - h.v.
Fracția de masă a unei substanțe pure se găsește prin formula: h.v. = m q.v. / m vezi, exprimă-l în fracții de unitate sau ca procent. Distingem 2 tipuri de sarcini.
Dacă în starea problemei este dată fracția de masă a unei substanțe pure sau fracția de masă a impurităților, atunci este dată masa amestecului. Cuvântul „tehnic” înseamnă și prezența unui amestec.
Ordinea soluției:
1. Aflați masa unei substanțe pure folosind formula: m p.m. = q.v. vad eu.
Dacă este dată fracția de masă a impurităților, atunci mai întâi trebuie să găsiți fractiune in masa substanță pură: h.v. = 1 - aprox.
2. Pe baza masei unei substanțe pure, faceți calcule suplimentare conform ecuației.
Dacă starea problemei dă masa amestecului inițial și n, m sau V a produsului de reacție, atunci trebuie să găsiți fracția de masă a substanței pure din amestecul inițial sau fracția de masă a impurităților din acesta.
Ordinea soluției:
1. Calculați conform ecuației, pe baza datelor pentru produsul de reacție și găsiți n ore. și m h.v.
2. Aflați fracția de masă a unei substanțe pure într-un amestec folosind formula: q.v. = m q.v. / m vezi și fracția de masă a impurităților: aprox. = 1 - h.c.
Lege relaţii volumetrice gazele.
Volumele de gaze sunt legate în același mod ca și cantitățile lor de substanțe:
V 1 / V 2 = 1 / 2
Această lege este folosită în rezolvarea problemelor prin ecuații în care este dat volumul unui gaz și este necesar să se afle volumul altui gaz.
Fracția volumică de gaz din amestec.
Vg / Vcm, unde (phi) este fracția de volum a gazului.
Vg este volumul gazului, Vcm este volumul amestecului de gaze.
Dacă fracția de volum a gazului și volumul amestecului sunt date în starea problemei, atunci, în primul rând, trebuie să găsiți volumul gazului: Vg = Vcm.
Volumul amestecului de gaze se găsește prin formula: Vcm \u003d Vg /.
Volumul de aer cheltuit pentru arderea unei substanțe se află prin volumul de oxigen găsit prin ecuația:
Vair \u003d V (O 2) / 0,21
Derivarea formulelor substanţelor organice prin formule generale.
Substanțele organice formează serii omoloage care au formule comune. Asta permite:
1. Exprimați greutatea moleculară relativă în termeni de număr n.
M r (C n H 2n + 2) = 12n + 1 (2n + 2) = 14n + 2.
2. Echivalați M r exprimat în termeni de n cu adevăratul M r și găsiți n.
3. Compuneți ecuații de reacție în vedere generalași efectuați calcule pe ele.
Derivarea formulelor substanțelor prin produse de combustie.
1. Analizați compoziția produselor de ardere și trageți o concluzie despre compoziția calitativă a substanței arse: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na 2CO3 -> Na, C.
Prezența oxigenului în substanță necesită verificare. Desemnați indicii din formulă ca x, y, z. De exemplu, CxHyOz (?).
2. Aflați cantitatea de substanțe ale produselor de ardere folosind formulele:
n = m / M și n = V / Vm.
3. Aflați cantitățile de elemente conținute în substanța arsă. De exemplu:
n (C) \u003d n (CO 2), n (H) \u003d 2 ћ n (H 2 O), n (Na) \u003d 2 ћ n (Na 2 CO 3), n (C) \u003d n (Na 2 CO 3) etc.
4. Dacă o substanță cu compoziție necunoscută a ars, atunci este imperativ să verificați dacă conține oxigen. De exemplu, СxНyОz (?), m (O) \u003d m in-va - (m (C) + m (H)).
b) dacă se cunoaște densitatea relativă: M 1 = D 2 M 2 , M = D H2 2, M = D O2 32,
M = D aer. 29, M = D N2 28 etc.
1 mod: găsiți cea mai simplă formulă a unei substanțe (vezi algoritmul anterior) și cea mai simplă masă molară. Apoi comparați masa molară adevărată cu cea mai simplă și creșteți indicii din formulă de numărul necesar de ori.
2 mod: găsiți indicii folosind formula n = (e) Mr / Ar (e).
Dacă fracția de masă a unuia dintre elemente este necunoscută, atunci trebuie găsită. Pentru a face acest lucru, scădeți fracția de masă a altui element din 100% sau din unitate.
Treptat, în cursul studierii chimiei în dicționarul chimic, se acumulează algoritmi pentru rezolvarea problemelor tipuri diferite. Iar studentul știe întotdeauna unde să găsească formula potrivită sau informațiile potrivite pentru a rezolva problema.
Mulți studenți le place să păstreze un astfel de caiet, ei înșiși îl completează cu diverse materiale de referință.
În ceea ce privește activitățile extracurriculare, elevii și cu mine începem și un caiet separat pentru scrierea algoritmilor de rezolvare a problemelor care depășesc curiculumul scolar. În același caiet, pentru fiecare tip de sarcină, notăm 1-2 exemple, ele rezolvă restul sarcinilor într-un alt caiet. Și, dacă vă gândiți bine, dintre miile de sarcini diferite întâlnite la examenul la chimie în toate universitățile, se pot distinge sarcini de 25 - 30 de tipuri diferite. Desigur, există multe variații între ele.
În dezvoltarea algoritmilor de rezolvare a problemelor din clasele opționale, A.A. Kushnarev. (Învățarea rezolvării problemelor din chimie, - M., Școala - presă, 1996).
Capacitatea de a rezolva probleme de chimie este principalul criteriu de asimilare creativă a subiectului. Un curs de chimie poate fi stăpânit eficient prin rezolvarea unor probleme de diferite niveluri de complexitate.
Dacă un student are o idee clară despre toate tipurile posibile de sarcini, a rezolvat un număr mare de sarcini de fiecare tip, atunci este capabil să facă față promovării examenului de chimie sub forma examenului unificat de stat și să intre în universități .
semne chimice
SEMNE CHIMICE (simboluri chimice) desemnări cu litere ale elementelor chimice. Ele constau din prima sau prima și una dintre următoarele litere ale numelui latin al elementului, de exemplu, carbon - C (Carboneum), calciu - Ca (Calciu), cadmiu - Cd (Cadmium). Pentru a desemna nuclizi, semnelor lor chimice li se atribuie un număr de masă în stânga sus și uneori un număr atomic în stânga jos, de exemplu. Semnele chimice sunt folosite pentru a scrie formule chimice.
Semne chimice
simboluri chimice, denumiri abreviate cu litere ale elementelor chimice. Modern Z. x. (vezi tabel) constau din prima literă sau prima și una dintre următoarele litere ale numelui latin al elementelor. În formulele chimice și ecuațiile chimice, fiecare Z. x. exprimă, pe lângă denumirea elementului, masa relativă egală cu masa sa atomică. Pentru a desemna izobare și izotopi la Z lor. x. un număr de masă este atribuit de sus la stânga (uneori la dreapta); Numărul atomic este scris în stânga jos. Dacă vor să desemneze nu un atom neutru, ci un ion, atunci pun încărcătura ionului în dreapta sus. În dreapta jos, este indicat numărul de atomi ai unui element dat dintr-o moleculă. Exemple: ═≈ ion izotop de clor încărcat unic (număr atomic 17, număr de masă 35); ═≈ moleculă diatomică a aceluiași izotop. Izobarele de argon și calciu sunt notate cu ═u, respectiv. Date în tabelul Z. x. sunt internaționale, dar odată cu acestea, în unele țări, sunt utilizate în mod obișnuit semne derivate din denumiri naționale de elemente. De exemplu, în Franța în loc de Z. x. azotul N, beriliul Be și wolfram W sunt acceptate Az (Azot), Gl (Glucinium) și Tu (Tungstène). În Statele Unite, Cb (Columbium) este adesea folosit în loc de Nb pentru niobiu. Numele și semnele elementelor cu numere atomice 102 și 103 („nobeliu” și „lawrencium”) nu sunt în general acceptate. Referință istorică. Chimiștii din lumea antică și din Evul Mediu au folosit imagini simbolice, abrevieri de litere, precum și combinații ale ambelor pentru a desemna substanțe, operații chimice și dispozitive. orez.). Cele șapte metale ale antichității au fost înfățișate ca semne astronomice ale celor șapte corpuri cerești: Soarele (aur), Luna (argint), Jupiter (staniu), Venus (cupru), Saturn (plumb), Mercur (mercur), Marte ( fier). Metalele descoperite în secolele XV-XVIII - bismut, zinc, cobalt - erau notate prin primele litere ale numelui lor. Semnul rachiului de vin (lat. spiritus vini) este alcătuit din literele S și V. Semnele vodcăi puternice (lat. aqua fortis, acid azotic) și vodcăi aurii (lat. aqua regis, aqua regia, un amestec de acizii clorhidric şi azotic) sunt formaţi din semnul apei С şi litere mari F, respectiv R. Semnul sticlei (latină vitrum) este format din două litere V ≈ drepte și inversate. Încercările de a eficientiza vechiul Z. x. a continuat până la sfârșitul secolului al XVIII-lea. La începutul secolului al XIX-lea Chimistul englez J. Dalton a sugerat desemnarea atomilor elementelor chimice prin cercuri, în interiorul cărora erau plasate puncte, liniuțe, literele inițiale ale denumirilor englezești de metale etc. Dalton a primit o oarecare distribuție în Marea Britanie și în Europa de Vest , dar au fost în curând înlocuite de Z. x. pur literal, pe care chimistul suedez I. Ya. Berzelius l-a propus în 1814. Principiile pe care le-a exprimat pentru compilarea Z. x. și-au păstrat forța până în zilele noastre; sunt precizate la începutul articolului. În Rusia, primul mesaj tipărit despre Z. x. Berzelius a fost făcut în 1824 de medicul moscovit I. Ya. Zatsepin. Semne, nume, numere atomice și mase atomice ale elementelor chimice Semn* Nume latin Nume rus Număr atomic Masă atomică** Semn* Nume latin Nume rus Număr atomic Masă atomică** Ac Actinium Actinium 89 [ 227] Mg Mgnesiom Magneziu 12 24,305 Ag Argentum Argint 47 107,8680 Mn Mangan Mangan 25 54,9380 Al Aluminiu Aluminiu 13 26,98154 Mo Molebdaenum Molibden 42 95,94 Am Americiu Americiu 95 N Azot Azot Azot 7 14,006,98 Argonum Na3 Argoniu Argon 91,94 Sodiu 22 .98977 As Arsenicum Arsenic 33 74.9216 Nb Niobiu Niobiul 41 92.9064 At Astatium Astatium 85 Nd Neodim Neodim 60 144,24 Aurum Aur 79 196,9665 Ne Neonum Neon 10 20,179 B Bor Bor 5 10,810 Nicco lum Nichel 28 58, 71 . Fii Beriliu Beriliu 4 9,01218 Np Neptuniu Neptunium 93 237,0482 Bi Bismut Bismut 83 208,9804 O Oxigen Oxigen 8 15,9994 Bk Berkelium Berkelium th 97 Os Osmiu Osmiu 76 190,2 Br Brom Brom 35 79,954 Phosphorus Phosphorus 79,954 Phosphorus 79,954 eum Carbon 6 12,011 Pa Protactinium Protactinium 91 231,0359 Ca Calciu Calciu 20 40,08 Pb Plumbum Plumb 82 20 7,2 Cd Cadmiu Cadmiu 48 112 ,40 Pd Paladiu Paladiu 46 106,4 Ce Ceriu Ceriu 58 140,12 Pm Prometiu Prometiu 61 Cf Californiu California 98 Po Poloniu Poloniu 84 Cl. Pramioză Clor 84 Cl. odim 59 140,9077 Cm Curium Curium 96 Pt Platină Platină 78 195, 09 Co Cobalt Cobalt 27 58,9332 Pu Plutoniu Plutoniu 94 Cr Crom Crom 24 51,996 Ra Radiu Radiu 88 226,0254 Cs Cesiu Cesiu 55 132,9054 Rb. 46 Re Reniu Reniu 75 186,2 Dy Disprosium Disprosium 66 162,50 Rh Rodiu Rodiu 45 102,9055 Er Erbiu Erbiu 68 167,26 Rn Radonum Radon 86 Es Einsteinium Einsteinium 99 Ru Ruteniu Ruteniu 44 101,07 Eu Europiu Europiu 63 151,96 S Sulphur F Sulphur Fluo .186 . 0 Sb Stibium Antimoniu 51 121,75 Fe Ferrum Fier 26 55,847 Sc Scandiu Scandiu 21 44,9559 Fm Fermium Fermium 100 Se Selenium Selenium 34 78,96 Fr Francium Francium 87 Si Silicium Silicon 14 28,086 Ga Gall ium Gallium 31 69,72 Sm Samarium Samarium 62 150.5 G Gadolinium S. 0 118,69 Ge Germaniu Germaniu 32 72,59 Sr Stronțiu Stronțiu 38 87,62 H Hidrogen Hidrogen 1 1,0079 Ta Tantal Tantal 73 180,94 9 He Heliu Heliu 2 4,00260 Tb Terbiu Terbiu 65 158,9254 Hf Hafniu Hafniu 72 178,49 Tehneciu 989432 Tehneciu 989432 Tehneciu 98943 cury 80 200,59 Te Tellurium Tellurium 52 127,60 Ho holmium Holm 67 164,9304 Th Thorium Thorium 90 232,0381 I Iod Iod 53 126,9045 Ti Titan Titan 22 47,90 In Indi Indi 49 114,82 Tl Taliu Taliu 81 204,37 Ir Iridiu Iridiu 77 192,22 Tul6 Potasiu 9693 192,22 Tl Tul6 Potasiu 9693 19 39,098 U Uraniu Uraniu 92 238,029 Kr Kryptonum Krypton 36 83,80 V Vanadiu Vanadiu 23 50,94 Ku Kurtschatovim Kurchatovium 104 W Wolframium Tungsten 74 183,85 La Lanthanum Lantan 57 138,9055 Xenon Xenon 54 131,30 Li Litiu 3 6,941 Y Yttrium Yttrium (88L9309) Yb Iterbiu Iterbiu 70 173,04 Lu Lutețiu Lutețiu 71 174,97 Zn Zinc Zinc 30 65,38 Md Mendelevium Mendelevium 101 Zr Zir conium Zirconiu 40 91, 22 * Semnele și denumirile neobișnuite ale elementelor cu numerele atomice 102 și 103 sunt date între paranteze. ** Masele atomice sunt date pe scara carbonului ( masă atomică izotopul de carbon 12C este egal cu 12 exact) și corespunde tabelului internațional 197
Numerele de masă ale izotopilor cu cea mai lungă viață ai elementelor radioactive sunt date între paranteze drepte.
Lit.: Lomonosov M.V., Poln. col. soch., vol. 2, M. ≈ L., 1951, p. 706≈709; Dzhua M., Istoria chimiei, trad. din italiană., M., 1966; Crosland M. P., Studii istorice în limbajul chimiei, L., 196