Introducere în soluțiile de clorură ferică a unei componente organice. Clorura ferică și înlocuitorii săi. Domeniul de aplicare al clorurii ferice
Această soluție este cea mai comună, de obicei conține o cantitate mică de acid clorhidric. Formula chimică generală a procesului de gravare este 2FeCl 3 +Cu CuCl 2 +2FeCl 2 .
La fabricarea plăcilor cu circuite imprimate concentrația maximă de cupru în soluția de decapare este de 50...60 kg/m 3 , apoi soluția este regenerată. Concentrația (densitatea) soluției de clorură ferică are, de asemenea, un efect semnificativ asupra calității gravării. Greutatea specifică a soluției ar trebui să fie de 1,36 ... 1,38. S-a stabilit că în soluțiile mai diluate de clorură ferică, gravarea are loc mai rapid decât în soluțiile concentrate, totuși, astfel de soluții își pierd foarte repede capacitatea de oxidare, iar viteza de gravare scade rapid. În practică, adecvarea unei soluții de decapare este adesea determinată de culoarea acesteia, iar o soluție care și-a schimbat culoarea de la maro la verde închis este înlocuită cu una proaspătă.
Pentru a reduce gravarea conductorilor imprimați, în soluția de clorură ferică se introduc uree, gelatină, dietilbenzen sau ulei de ricin sulfonat. Rata de gravare a cuprului crește odată cu creșterea temperaturii soluției și scade odată cu acumularea de cupru în ea. Deși teoretic 10 -3 kg de FeCl 3 dizolvă 2 10 -4 kg de Cu, în practică, având în vedere efectul dăunător al acumulării de cupru în soluție asupra vitezei de gravare, soluția de decapare poate fi utilizată atunci când conținutul de cupru nu este mai mare decât 60 kg/m3. Temperatura recomandată este de 308 K. Soluția de clorură ferică are o viteză mare și uniformă de gravare a cuprului. Acest lucru se datorează faptului că clorura ferică gravează uniform atât granulul de metal în sine, cât și zona de la limita dintre boabe, iar persulfatul de amoniu dizolvă în primul rând zona de la limita dintre boabe, ceea ce duce la gravarea neuniformă, dând o margine zimțată mare.
O soluție de clorură ferică se caracterizează printr-un conținut mai scăzut de substanțe toxice decât alte soluții de decapare. Această soluție păstrează o activitate suficientă chiar și la un conținut relativ ridicat de cupru dizolvat. Cu toate acestea, soluțiile de clorură ferică au multe dezavantaje. Principalul lucru este imposibilitatea utilizării acestuia pentru plăci acoperite cu un aliaj de staniu-plumb și inadmisibilitatea aruncării soluției uzate în canalizare fără o prelucrare suplimentară. În plus, s-a constatat că utilizarea prelungită a soluției duce la formarea unui precipitat mâloasă, care este un amestec de cupru filtrabil și oxid de fier. Cele mai mici particule de oxid acoperă suprafața cu un strat subțire, durabil și neted, ca o oglindă, care este greu de îndepărtat de pe placă cu spălarea obișnuită. Aceste produse de gravare sunt adesea cauza proprietăților de izolare reduse. Prin urmare, multe firme străine au limitat drastic utilizarea clorurii ferice și folosesc soluții noi.
După cum știți, clorura ferică este folosită în mod tradițional atât în industria tipografică, cât și pentru fabricarea plăcilor de circuite imprimate. Pentru această soluție au fost dezvoltate multe metode de regenerare și eliminare. Dificultățile tehnologice în implementarea acestor procese duc la faptul că întreprinderile nu primesc întotdeauna un efect economic semnificativ.
Regenerarea soluției de decapare pe bază de clorură ferică poate fi efectuată, de exemplu, după cum urmează. În primul rând, cuprul este îndepărtat (de exemplu, prin precipitarea de contact pe așchii de oțel). După aceea, pH-ul este setat la 1,6, se introduce un agent de oxidare (peroxid de hidrogen sau altul) pentru a transforma Fe 2+ în Fe 3+ (operația de oxidare se poate realiza și prin barbotarea clorului prin soluție) și conținutul de FeC1 3 este ajustată la suma necesară.
Industria autohtonă a stăpânit metoda de curățare a soluțiilor de gravare a reziduurilor de clorură ferică cu utilizarea cuprului. Soluțiile de decapare reziduale de clorură ferică se caracterizează printr-un conținut ridicat de fier (până la 150 kg/m3) și cupru (până la 50 kg/m3). Cuprul din soluția de decapare de clorură ferică uzată este extras prin cementare pe plăci vibrante de oțel sau resturi de oțel. Soluția rezultată este neutralizată cu lapte de var sau sodă caustică și precipitatul este deshidratat.
În practică, soluția de gravare uzată de clorură ferică din magazinul de circuite imprimate intră în vibrocimentare, unde cuprul este eliberat pe sarcina care conține fier. Precipitatul de cupru de ciment este trimis pentru deshidratare la un dispozitiv de filtrare, iar soluția este trimisă la un neutralizator. Suspensia din neutralizator este pompată în centrifugă de o pompă. Centrifuga care contine mai putin de 5 10 "4 kg/m 3 de fier si 1 10 4 kg/m 3 de cupru este evacuata in canal, iar namolul deshidratat este scos pentru reciclare.
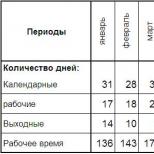
Pentru a crește factorul de utilizare al soluțiilor de decapare pe bază de clorură ferică, au fost dezvoltate metode pentru utilizarea lor repetată prin adăugarea de clorură de amoniu și trecerea clorului prin soluție. Pulbere de clorură de amoniu zdrobită umezită cu o cantitate mică de apă distilată a fost adăugată la soluția uzată cu agitare; soluția a fost încălzită la 323 ... ... 333 K. După aceea, clorul a fost trecut prin ea folosind barbotare. Studiile efectuate au permis stabilirea modului optim de regenerare a soluției de clorură ferică uzată: la fiecare litru se adaugă 5,5-10 -3 kg de clorură de amoniu și se trece prin 0,013 m 3 de clor. Dependența timpului de decapare de numărul de regenerări la o densitate de încărcare constantă (9,4 dm 2 /l) este prezentată în Tabelul 7. Ca urmare a introducerii unei regenerări de 4 ori a soluției de clorură ferică, s-a obținut un efect economic ridicat.
De asemenea, sunt dezvoltate metode electrochimice pentru regenerarea soluțiilor de clorură ferică. Primele experimente privind regenerarea electrochimică a acestor soluții în producția de plăci de circuite imprimate au fost descrise în 1953.
Tabelul 7
Timp de gravare in functie de numarul de regenerari efectuate.
Esența regenerării electrochimice este separarea cuprului pe un catod de titan și oxidarea anodică a FeCI 2 la FeCl 3 pe un anod de grafit. În procesul catodic, împreună cu eliberarea de miere, are loc o reacție nedorită de reducere a Fe 3+ la Fe 2+. Ponderea cuprului izolat în procesul total catodic crește semnificativ odată cu creșterea conținutului de cupru din soluție. Cu toate acestea, soluțiile mixte de forma FeCl 3 +CuCI 2 au proprietăți de gravare mai slabe decât o soluție de FeCl 3 monocomponent. În soluțiile mixte, interacțiunea CuCl 2 cu cuprul duce la o formare mai accelerată a unei pelicule de monoclorură de cupru puțin solubilă pe suprafața metalului, ceea ce împiedică gravarea ulterioară.
Introducerea clorurilor de metale alcaline și de amoniu, care formează complexe bine solubile cu cupru monovalent și acid clorhidric, în soluție îmbunătățește semnificativ caracteristicile soluțiilor de decapare. Intensificarea procesului de gravare a cuprului în soluții cu astfel de aditivi se datorează facilitării celei de-a doua etape chimice a oxidării cuprului (îndepărtarea de pe suprafață și oxidarea ulterioară a peliculei de monoclorură de cupru formată inițial) și creșterea gradului de participare a cuprului. CuCI 2 în procesul de gravare. Pe măsură ce soluția de gravare mixtă „se uzează” („îmbătrânire”), contribuția Cu 2+ la rata totală de gravare crește. După consumul de 50% FeCl 3, gravarea cuprului are loc deja în principal datorită diclorurii de cupru, care a fost inițial în soluție și s-a format în timpul gravării.
|
Componente | ||
„Densitatea soluției este de 1,32 .. . 1,34 kg/m 3.
Aceste soluții sunt mai scumpe, deoarece conțin mai multe substanțe chimice, dar utilizarea lor repetată după regenerare, reducerea costului de neutralizare a soluțiilor uzate și fluctuațiile mai mici ale vitezei de gravare atunci când se utilizează regenerarea continuă - toate acestea fac în cele din urmă posibilă în mod semnificativ reduce costurile procesului de gravare.
Sinonime: clorură ferică (soluție de clorură de fier), clorură ferică.
Descriere: O soluție de clorură ferică este un lichid caustic, nevolatil, brun-maro. Produsul respectă cerințele STO 00203275-228-2009
Caracteristicile chimice ale clorurii ferice
În funcție de perioada anului, temperatura aerului, clorura ferică este produsă în 1 sau 2 grade.
Caracteristicile fizice ale clorurii ferice
Greutate moleculară: 162,21 g/mol
Punctul de fierbere variază între 100-106°C.
Valoarea pH-ului este aproximativ egală cu de la 1 la 2.
La gravarea cuprului într-o soluție de clorură ferică, capacitatea maximă de dizolvare este de 100 g / 1 l. Viteza de gravare la 50–55°C este de 4,3–5 µm/min.
Densitățile soluțiilor apoase de clorură de fier sunt prezentate în Fig. 1:
Domeniul de aplicare al clorurii ferice
Clorura ferică este utilizată în industrii precum: stații de epurare a apelor uzate, utilități de apă, prelucrarea metalelor, chimică, alimentară, berii, piele, ulei etc.
Utilizarea principală a soluției de clorură ferică este în tratarea apelor industriale și uzate, ca coagulant primar. Sub acțiunea clorurii ferice, are loc un proces fizico-chimic de mărire, aderență a particulelor mici (coagulare), care contribuie la precipitarea unui precipitat floculent din soluția coloidală sau la formarea unui gel, care, ulterior, este ușor de îndepărtat. din apele uzate tratate. La curățarea cu clorură ferică, cantitatea de impurități insolubile din apa uzată este redusă la 95%, solubilă la 25%.
În comparație cu unii coagulanți, clorura ferică are o serie de avantaje, acestea sunt:
- suficient de mare viteză precipitarea impurităților.
- efect pozitiv asupra descompunerii biochimice a impurităților precipitate, a nămolului activ.
- cost mai mic comparativ cu alți coagulanți obișnuiți.
Clorura ferică este, de asemenea, utilizată:
- ca catalizator în procesele de sinteză organică.
- pentru gravarea metalelor (placi de circuite imprimate, forme imprimate)
- ca mordant la vopsirea țesăturii.
- ca aditiv pentru creșterea rezistenței betonului.
Clasa de pericol pentru clorura ferică
Soluția de clorură ferică este un lichid caustic, nevolatil, corosiv.
Rezistent la foc și la explozie.
La contactul cu pielea, clorura ferică provoacă iritații, mâncărimi, piele uscată, dermatită. Dacă intră în ochi, provoacă iritarea membranei mucoase. Clătiți imediat pielea sau ochii cu multă apă și solicitați asistență medicală dacă este necesar. Când lucrați, este necesar să folosiți echipament individual de protecție.
Număr ONU 2582
Ambalarea, transportul și depozitarea clorurii ferice
Transportat cu orice mod de transport în conformitate cu normele de transport de mărfuri periculoase în vigoare pentru acest mod de transport.
Soluția este transportată în cisterne de cale ferată sau de camioane din oțel căptușite cu cauciuc, precum și în containere speciale cu o capacitate de până la 1000 dm3.
Clorura ferică trebuie depozitată în recipiente din cauciuc, titan sau polietilenă.
În sezonul rece, produsul este depozitat în depozite închise cu respectarea regimului de temperatură.
Termen de valabilitate garantat - un an de la data fabricației.
Nu este supusă certificării obligatorii.
Atenţie! Eu însumi nu am încercat această metodă, doar am citit despre ea într-o carte!
Pentru fabricarea clorurii ferice, trebuie să luați fier rumeguș sau plăci subțiri și umpleți-le cu o soluție de acid clorhidric (HCl).
Rumegul este lăsat câteva zile într-un recipient deschis. După câteva zile, soluția va deveni verde.
După aceea, soluția rezultată este scursă și după un timp este gata de „lucrare”!
P.S. La 13 iulie 2007, am primit o scrisoare de la respectatul Vladimir Syrov, în care scria următoarele:
De zeci de ani, o poveste despre posibilitatea de a face clorură ferică acasă rătăcește în literatura de radio amatori. Aici și pe acest site există așa ceva (vezi mai sus).
Un autor necunoscut spune sincer „Eu însumi nu am încercat această metodă”. Dar, se pare, NIMENI dintre cei care au scris vreodată despre asta nu a încercat această metodă !!! Și servitorul tău ascultător a încercat-o în anii 90, iar rezultatele sunt de așa natură încât este mai bine să nu încerci nici măcar să o faci.
Fierul poate fi fie trivalent, fie divalent. Atunci când este combinat cu clorul, se obțin două formule - „ferrum clor doi” și „ferrum clor trei”. Primul este cristale verzi, al doilea este galben-maro. Doar clorura ferică este potrivită pentru gravarea plăcilor de circuite imprimate din cupru, „clorul de ferum doi” nu funcționează - a fost stabilit prin experiență. Sau cel puțin nu funcționează bine. Iar prin metoda artizanală descrisă (turnarea piliturii de fier cu acid clorhidric), conform unor legi ale chimiei, se obține tocmai „clorul de fer doi”. În unele publicații mai detaliate pe această temă, acest fapt pare să fie luat în considerare - ei scriu ceva de genul „dacă primești o culoare verzuie
soluție - lăsați-o să stea în aer liber, astfel încât să devină maro-gălbui." A fost verificat prin experiență - nu funcționează! A stat săptămâni și luni ... O parte nesemnificativă a fierului feros este oxidată la feric, dar nu mai mult.
Am incercat sa incalzesc solutia, sa o evapor, sa o usuc si sa las cristale verzui in aer.... Sa mai oxidez prin trecerea oxigenului mai intai prin solutie, iar apoi a clorului....Totul este inutil! Aproape că m-am otrăvit și nu i-am otrăvit pe alții, ci practic rezultat semnificativ, „ferrum clor trei” nu a primit o eliberare notabilă!
Vă rog să fiți atenți la faptul că aici avem de-a face cu otrăvuri! Acidul clorhidric este o soluție de cenușă-clor gazos în apă. Din el se evaporă „gazele”, adică „clorul de cenușă”. Acest gaz, combinat cu apa pe mucoasele organelor respiratorii (nas, gura, trahee si bronhii, plamani) - se transforma in acelasi acid clorhidric! Clorul, pe care am reușit să-l obțin în cantități suficiente, este în general o otravă specifică. Merită să ne gândim la faptul că sănătatea este mai scumpă! În prezent, în orice oras important nu este nici o problema sa cumperi clorura ferica de undeva pe piata radio si sa nu suferi cu fabricarea acesteia. După cum s-a dovedit, în industrie, clorul (nu clorura!) fierul este obținut într-un mod complet diferit - prin arderea fierului într-o atmosferă de clor. Este de la sine înțeles că această metodă este greu fezabilă acasă.
Chiar și în prezența clorurii ferice gata preparate, v-aș sfătui să aveți grijă - să otrăviți undeva sub curent de aer, pe un balcon, undeva într-un garaj .... Pentru a proteja sănătatea nu numai a dumneavoastră, ci și a dumneavoastră. cei ai familiei tale apropiate. Ca să nu mai vorbim de plumb, care face parte din lipirea staniu-plumb. Cantități foarte mici de vapori
plumbul, pătrunzând în organism, provoacă în cele din urmă otrăvire cronică, diverse boli, inclusiv carii dentare .... Nu degeaba există instrucțiuni foarte stricte pentru instalarea ventilației de evacuare la locul de muncă. Dar acasă, în viața de zi cu zi, radioamatorii neglijează foarte des acest lucru, dar în zadar. De fapt, acest avantaj este destul de suficient
Puțin. Numai că consecințele nu vin imediat... Și nici în cloruri sunt puține bune...
Așa că autorul publicației (citând pe cineva) scrie: „după un timp soluția va deveni verde”. Va fi clorură feroasă și nu ceea ce ar fi trebuit să se obțină. Și despre faptul că „după ceva timp” va fi încă gata de muncă... Vai. Daca nu ma crezi, incearca si tu! Și numai atunci poți să scrii o rețetă când aceasta
verificat personal prin experiență. Nu merită să scrii din cuvintele altora.
Confruntați cu procesul de creare a plăcilor cu circuite imprimate acasă, începătorii pun adesea o întrebare simplă pe diverse forumuri despre cum să diluați clorura ferică. Se pare că acest subiect nu este atât de amplu încât să îi dedicăm un articol amplu, dar după ce ne-am gândit puțin, ne-am hotărât totuși la o notă mică.
La vânzare puteți găsi două tipuri de clorură ferică:
- Clorura ferică hexahidrat. Seamănă cu nisipul umed de culoare galben-portocalie.
- Clorura ferică anhidră. Pulbere sau bulgări de culoare neagră.
Și asta și un alt textolit perfect otravă. Timpul de gravare cu o soluție proaspăt preparată este de aproximativ 5 minute, iar cu o soluție veche, timpul de gravare poate crește până la 20 de minute sau mai mult. Pentru claritate, vom pregăti destul de multă soluție și vom arăta cum să diluăm clorura ferică pe plăci de gravare.
În primul rând, ne deschidem recipientul cu clorură ferică. Încercăm să nu le murdărim mâinile, hainele și masa, pentru că. este aproape imposibil să spălați sau spălați materialul.
Pregătim vase cu apă în care vom face o soluție de clorură ferică. Vasele trebuie să fie din plastic sau ceramică, utilizarea recipientelor și instrumentelor metalice este strict inacceptabilă. În mod ideal, este mai bine să luați apă distilată, dar în practică toată lumea se descurcă cu apă caldă fiartă.

Se toarnă clorură ferică într-un recipient cu apă cu o lingură de plastic și se amestecă constant.
Este mai bine să adăugați o jumătate de linguriță de clorură ferică, soluția se va încălzi treptat și se vor elibera și gaze. Aproximativ raport soluție 1:3(adică o parte clorură ferică la trei părți apă) în greutate.

Concentrația poate fi determinată și de ochi, o soluție bună ar trebui să fie culoarea ceaiului tare. De fapt, puteți dilua clorura ferică după cum doriți, dar rata de gravare a plăcii va depinde direct de acest lucru.

Procesul de gravare în sine se face cel mai bine într-o soluție ușor încălzită. După gravarea plăcilor, soluția de clorură ferică uzată trebuie depozitată într-un loc întunecat într-un recipient sigilat până la următoarea utilizare.
Sperăm că nota noastră va fi utilă. Abonați-vă la paginile noastre de pe rețelele sociale și nu ratați lansarea de noi materiale utile.
In contact cu
Clorura ferică este unul dintre cei mai comuni reactivi pentru gravarea plăcilor de circuite imprimate. Soluția nu este agresivă, cum ar fi acidul azotic, dar are suficientă rezistență pentru a deveni cu un ordin de mărime mai mare decât soluția de sulfat de cupru și alți peroxizi de hidrogen cu acid citric. Prin urmare, când a devenit necesară realizarea unei plăci de circuit imprimat mic, alegerea mea a fost evidentă. Dar apoi m-a așteptat o surpriză - nu era clorură ferică în orașul nostru. „A dispărut de mult”, a spus vânzătoarea unuia dintre magazinele de radio. A trebuit să-l iau pe internet, tot am comandat componente radio. Pretul a iesit 40 UAH. (≈1,7 USD) pentru 250 de grame. Ținând cont de faptul că fac ceva rar, din lipsă de timp, această cantitate de clorură ferică îmi va rezista mult timp.
Ei bine, serviciile de curierat sunt în program, nu a trebuit să așteptăm mult. Ambalajul este realizat în sticla de sifon PET. Sticla era opaca si era imposibil sa se vada volumul. Totul arăta așa:
Pentru depozitare, mi se pare foarte convenabil. După ce mi-am mototolit sticla în mâini, mi-am dat seama că aveam o substanță pastoasă înăuntru și nu mă lăsa să părăsesc sticla atât de ușor. A deșurubat capacul, s-a asigurat că în interior era exact clorură ferică (nu vei mai uita niciodată mirosul lui) și s-a apucat să caute recipientul necesar.

Alegerea recipientului pentru depozitarea și utilizarea clorurii ferice trebuie abordată în mod responsabil. Pentru muncă, ar trebui să fie confortabil, pentru depozitare - în siguranță.
Trebuie să știi asta ca urmare reacții chimice clorul și acidul clorhidric se vor volatiliza constant din soluție. Toate aceste substanțe sunt otrăvuri. Este necesar să se lucreze cu clorură ferică în zone bine ventilate (de preferință în aer liber), de asemenea, este interzis să se aplece direct peste vasul cu soluția pentru a evita inhalarea substanțelor toxice. Vă sfătuiesc să-l depozitați într-un loc greu accesibil (bine, bine ventilat), astfel încât nici un copil, nici un pisoi să nu poată răsturna, sparge, vărsă soluția de lucru. (Voi vorbi despre consecințe mai târziu în text).
După ce am comparat toate faptele, am ales ca vas o tavă din plastic pentru alimente.

Acum una dintre cele mai importante întrebări - ce proporții să alegi? Nu m-am deranjat cu asta! Viteza de gravare depinde de concentrația de clorură ferică pură și de temperatura soluției. Adăugați mai mult - va fi mai rapid de murat și invers (o puteți adăuga oricând, dar în timp este mai ușor să înlocuiți soluția cu una complet nouă). Clorura ferică este foarte solubilă în apă, așa că puteți obține o astfel de concentrație încât gravarea va dura până la cinci minute.
Am turnat 0,5 litri in tava. apă caldă și a stors în ea aproximativ o jumătate de sticlă de clorură ferică (≈125g. ), amestecând continuu. Nu a fost ușor de stors. Rezultatul este o soluție ca în fotografia de mai jos.

Am decis să lucrez într-o baie cu ventilație forțată. Nu am o fotografie, dar vă sfătuiesc cu insistență să puneți soluția pe pungi de celofan sau de unică folosință și să le aruncați când ați terminat. Acest lucru este valabil și pentru depozitare! După ce ați vărsat soluția pe o țiglă, masă, linoleum, va trebui să depuneți mult efort pentru a le curăța. Cu cât producția de soluție este mai mare, cu atât va fi mai dificil de curățat.După contactul cu țesutul, în cele mai multe cazuri, va trebui să-și ia rămas bun. Pe baza acestui lucru, este imposibil să turnați minerit în canalizare. În primul rând, este otravă, iar în al doilea rând, vasul de toaletă alb ca zăpada va deveni maro-ruginiu. Acest lucru trebuie reținut!
Soluția am gravat-o o mică taxă în 15-20 de minute. În acest timp, l-am amestecat de câteva ori, mai ales la final, când cuprul de pe placă a început să dispară sub ochii noștri, până a dispărut complet.

Depozitez astfel de lucruri pe balcon, în colțul îndepărtat al raftului. Acidul azotic locuiește în cartier, dar îl folosesc atunci când, de exemplu, trebuie să fac o placă mică cu șine late. În unele locuri, corodează tonerul, nu vede markerul permanent - trebuie să desenați cu lac bituminos, ceea ce nu este foarte convenabil. Dar, după cum se spune, totul are un scop!

Tot cromul de pe piesele noastre apare ca rezultat al cromării galvanice.
Placare cu crom- este o metodă electrochimică de aplicare a acoperirilor metalice pe plastic. Concluzia este că sunt aplicate trei straturi de metal: cupru + nichel + crom. Cromul reacționează și se așează uniform pe suprafața produsului. Acest tip de cromare este folosit pentru emblemele auto, grilele radiatorului, suvenirurile etc. și așa mai departe.
Cum scapi de acest crom?
Există o opțiune de a lucra activ cu șmirghel, dar de foarte multe ori detaliile nu sunt niciodată uniforme, cu multe elemente mici. Pentru a jupui astfel - mâinile se vor ofili. De aceea, chimia, pe care ne place să o jucăm la școală, ne va ajuta!
Cel mai simplu mod este să punem piesa noastră de plastic într-o soluție de clorură ferică pentru un timp și să o murăm ca pe o placă de circuit imprimat.
Clorură de fier
Ce este clorura ferică?
Clorura ferică FeCl3 este o sare medie de fier feric și acid clorhidric. În aparență, această materie primă chimică este o masă cristalină moale de culoare ruginiu-maroniu-negru. Este folosit pentru gravarea plăcilor de circuite imprimate în industria electronică și a instrumentelor.
Gătitul.
Se obișnuiește să se pregătească o soluție de clorură ferică pe baza unui raport de 1 la 3 (1 parte de fier la 3 părți de apă) în greutate.
Soluția trebuie preparată într-un recipient nemetalic rezistent la căldură, în care se toarnă apă la o temperatură de aproximativ 60-80 de grade. Desigur, este recomandabil să folosiți apă fiartă, dar apa obișnuită de la robinet face o treabă excelentă în această sarcină. Conform științei, trebuie să folosiți apă distilată, dar, în practică, nimeni nu se deranjează cu asta - nu avem un laborator chimic!
Clorura ferică trebuie turnată în apă (! în niciun caz nu invers!) În porții mici, amestecând continuu soluția. Când este dizolvată, apa se va încălzi și va fi vizibilă o reacție destul de violentă (focot, șuierat, eliberare de abur, care este foarte descurajat de la inhalare). Va dura aproximativ 20 de minute pentru a se dizolva (totul depinde de volume), dar fierul de călcat se va dizolva complet și nu se va așeza pe fundul recipientului, nici soluția nu va fierbe sau recipientul nu se va topi. Un singur sfat - nu te grăbi!
După dizolvare, este necesar să se lase soluția să se stabilească. După 20 de minute se va putea observa depunerea hidroxidului de fier (rugina) pe fund, care este întotdeauna conținut în pulbere de clorură ferică și care previne gravarea. Este mai bine să dai o soluție
stați timp de 10-12 ore, astfel încât orice resturi, care sunt adesea prezente în clorura ferică, să se depună pe fundul rezervorului. După ce soluția s-a depus, aceasta trebuie filtrată într-un recipient curat, în care va fi efectiv depozitată. Soluția poate
ușor de utilizat în mod repetat și este stocat pentru o perioadă de timp arbitrar.
Ca rezultat, am obținut o soluție curată, transparentă, maro de clorură ferică.
Rezultat gravare:

Rezultat gravare
Recuperarea soluției
De fiecare dată după utilizare, soluția își va pierde rezistența, iar gravarea ulterioară va dura mai mult. Din nou, încălzirea și amestecarea soluției va ajuta la accelerarea procesului de gravare.
Soluția poate fi restabilită prin adăugarea de acid clorhidric la ea - o parte din hidroxid din nou
redus la clorură ferică. Dar cea mai ușoară cale este teribil de banală - aruncăm câteva cuie obișnuite în soluție, cuprul se va depune pe ele din soluție și soluția va câștiga din nou putere. Dar nu trebuie să abuzați de acest lucru, mai ales atunci când soluția este nouă - soluția se poate degrada și schimba treptat culoarea de la maro la verde.
Mai sunt câteva metode de recuperare, dar cu condiția să nu avem nevoie de soluția la scară industrială, nu le voi descrie.
Concluzie
În încheiere, aș dori să vă avertizez: mare atentie la clorura ferica!
Recomand să efectuați toate lucrările cu mănuși - clorura ferică mănâncă bine în mâini și se spală prost cu săpun, dacă ajunge pe piele poate provoca mâncărimi și iritații, până la arsuri la persoanele cu pielea sensibilă. În caz de contact cu ochii, clătiți-i cu multă apă curentă și, bineînțeles, consultați un medic.
Pace tuturor!
PS Fotografii găsite pe internet (clubul BMW din Belarus, google, yandex)
Clorura ferică (III) sub formă de soluție poate fi preparată în laborator sau acasă. Veți avea nevoie de ustensile nemetalice rezistente la căldură și curate fierbinți sau distilate). După dizolvare și decantare, se obține un lichid maro închis. Există o serie de caracteristici în prepararea unei soluții de clorură ferică despre care ar trebui să înveți înainte de a începe să lucrezi cu ea.
Clorură de fier
Clorura ferică anhidră, produsă de industria chimică - FeCl 3 - cristale maro închis cu nuanțe de roșu, violet, verde închis. Masa molara - 162,21 g / mol. Substanța se topește la o temperatură de 307,5 ° C, la 500 ° C începe să se descompună. O probă de sare anhidră se dizolvă în 100 g de apă:
- 74,4 g (0°C);
- 99 g (25 °C);
- 315 g (50 °C);
- 536 g (100 °C).
Anhidru (III) - o substanță foarte higroscopică, atrage rapid umiditatea din mediu inconjurator. În aer, interacționează cu apa, transformându-se în cristale galbene de hexahidrat de FeCl 3 + 6H 2 O. Fracția de masă a clorurii ferice anhidră dintr-o substanță achiziționată într-o rețea comercială ajunge la 95%. Există o cantitate mică de clorură ferică FeCl 2 și impurități insolubile. Denumirea comercială este clorură ferică. Substanța este rezistentă la foc și la explozie, dar soluția sa are un efect coroziv asupra obiectelor metalice.
Clorura de fier (III) hexahidrat

Pe lângă anhidru, industria produce hidrat cristalin, în care fractiune in masa clorura ferică (III) este de 60%. Substanța este o masă cristalină galben-maro sau bucăți libere de aceeași nuanță. O caracteristică distinctivă importantă a ionilor feroși și ferici este culoarea. Starea de oxidare a Fe 2+ este caracterizată printr-o nuanță verzuie, hexahidratul hidratului de clorură de fier este o substanță verde-albăstruie. În starea de oxidare a ionilor Fe 3+ capătă o culoare de la galben la maro. Pentru definiție calitativă reactanții acționează asupra unei soluții de clorură ferică:
- NaOH (apare un precipitat maro de Fe (OH) 3);
- K 4 (apare un precipitat albastru de KFe);
- KCNS, NaCNS (se formează tiocianat de fier roșu Fe(CNS) 3).
Cum se diluează clorura ferică

Clorura de fier (III) sub formă de soluție maro sau roșie poate fi găsită în rețeaua comercială, preparată în laborator sau acasă. În acest din urmă caz, veți avea nevoie cu siguranță de vase nemetalice rezistente la căldură (sticlă, plastic, ceramică). Apa pentru dizolvarea sării poate fi luată de la robinet. Mai sigur - fiert sau distilat. Apa încălzită la 50-70 ° C este plasată într-un recipient, apoi substanța este turnată în porții mici. Proporțiile de clorură ferică și apă sunt 1:3. Dacă pregătiți o soluție din hidrat cristalin, atunci va fi necesară mai puțină apă, deoarece este conținută în hidratul cristalin (40% din greutate). Substanța se adaugă în soluție puțin câte puțin, fiecare porție este de aproximativ 5-10 g. Nu se recomandă turnarea imediată a întregii probe din cauza naturii rapide a reacției de hidratare. Nu folosiți ustensile metalice (linguri, spatule). Sarea trebuie dizolvată complet în apă caldă, pentru care cristalele trebuie amestecate bine cu lichidul. Procesul este accelerat prin adăugarea de acid clorhidric (1/10 din masa cristalelor). După decantarea timp de câteva ore, în partea de jos poate apărea un precipitat datorită prezenței în probă și formării hidroxidului de fier în timpul reacției. Soluția de culoare maro închis preparată trebuie filtrată și depozitată într-un recipient de plastic bine închis, la o temperatură moderată și ferit de lumina directă a soarelui.
Utilizarea clorurii ferice în industrie și utilități publice. uz casnic
Sărurile de fier își găsesc aplicații în multe domenii. Clorura metalică trivalentă este utilizată pentru tratarea apei, pentru fixarea metalelor și a vopselei. Substanța este utilizată în sinteza organică industrială (catalizator, oxidant). Proprietățile de coagulare ale ionului Fe 3+ sunt deosebit de apreciate în tratarea apelor uzate municipale și industriale. Sub acțiunea clorurii ferice, mici particule insolubile de impurități se lipesc și precipită. De asemenea, există o legare a unei părți a contaminanților solubili, care sunt îndepărtați la stația de epurare. Hidratul de cristal și sarea anhidră FeCl 3 sunt utilizate în gravarea plăcilor de imprimare metalice. Betonului se adaugă o substanță pentru a-i consolida rezistența.
Fenomene chimice în timpul gravării plăcilor. Masuri de securitate

Popular Substanta chimica pentru gravarea plăcilor cu circuite imprimate - clorură ferică. O soluție în aceste scopuri se prepară din 0,150 kg de sare și 0,200 l de apă caldă. Conține ioni Fe 3+, Cl -, iar la hidroliză se formează un compus brun - hidroxid feric. Procesul decurge conform schemei: FeCl 3 + 3HOH ↔ Fe (OH) 3 + 3Cl - + 3H +. Dezavantajul acestei metode este contaminarea plăcii cu produse secundare de reacție, care fac dificilă gravarea ulterioară. Sarea în sine este o substanță nevolatilă, dar în procesul de interacțiune cu apa eliberează vapori caustici. Lucrările trebuie efectuate în aer liber sau într-o încăpere bine ventilată. Contactul cu soluția pe piele și mucoase duce la iritații și poate provoca dermatită. Trebuie folosit echipament individual de protectie (ochelari de protectie, manusi). În cazul contactului cu o soluție caustică, spălați pielea cu multă apă.
Clorură de fier
| Clorura de fier (III). | |
 |
|
| Sunt comune | |
|---|---|
| Nume sistematic | Clorura de fier (III). |
| Formula chimica | FeCl3 |
| rel. molek. greutate | 162 a. mânca. |
| Masă molară | 162,2 g/mol |
| Proprietăți fizice | |
| Densitatea materiei | 2,8 g/cm³ |
| Stat (Artă. conv.) | solid |
| Proprietati termice | |
| Temperatură de topire | 306°C |
| Temperatura de fierbere | 315°C |
| Proprietăți chimice | |
| Solubilitate in apa | 92 g/100 ml |
| Clasificare | |
| numar CAS | 7705-08-0 |
Clorura de fier (III)., clorură ferică FeCl 3 - sarea medie a trivalentului glandăȘi de acid clorhidric.
Proprietăți fizice
Frunze strălucitoare, ușor verzui, cu un luciu metalic. Este foarte higroscopic, în aer se transformă în FeCl 3 6H 2 O hidrat - cristale galbene higroscopice, ușor solubile în apă (la 20 ° C, 91,9 g de sare anhidră se dizolvă în 100 g de apă). T pl 309 °C.
Metode de achiziție
- cu cel mai mult metoda simpla Producția de triclorura de fier este acțiunea clorului gazos asupra piliturii de fier. Cu toate acestea, spre deosebire de acțiune de acid clorhidric, se formează o sare ferică:
- Triclorura se obține și prin oxidare clor clorură de fier (II):
- Există, de asemenea, o metodă destul de interesantă de oxidare oxid de sulf(IV). :
Proprietăți chimice
- Când este încălzit presiune atmosferică până la punctul de topire, descompunerea lentă a triclorurii de fier începe cu formarea de diclorură și moleculară. clor :
- Datorită faptului că triclorura de fier este un acid Lewis puternic, interacționează cu alții cloruri, în timp ce se formează săruri complexe ale acidului tetraclorofer:
- Când este încălzit până la 350°C cu oxid de fier (III). se formează oxoclorura de fier:
- Sărurile ferice sunt agenți de oxidare slabi, în special, triclorura de fier va oxida bine cuprul metalic, transformându-l în cloruri solubile:
Aplicație
- Clorura de fier (III) este utilizată pentru gravarea plăcilor de circuite imprimate.
- Este folosit ca mordant la vopsirea țesăturilor.
- Folosit la scară industrială ca coagulant pentru purificarea apei.
- Datorită proprietăților sale pronunțate acide, este utilizat pe scară largă ca catalizator V sinteza organica. De exemplu, pentru reacția de substituție electrofilă în hidrocarburi aromatice.
Vezi si
Fundația Wikimedia. 2010 .
- Clorhidrat de cloropiramină
- Cloroplaste
Vedeți ce este „clorura ferică” în alte dicționare:
Fier de călcat - obțineți un cupon de reducere Auchan funcțional la Akademika sau cumpărați fier de călcat ieftin cu transport gratuit la vânzările Auchan
FIER- vezi FIER (Fe). În apele de suprafață, conținutul de fier variază foarte mult. În sursele de apă subterane și în apele mlaștinilor, concentrația acestuia atinge zeci de mg/l. O creștere bruscă a fierului în corpurile de apă are loc atunci când acestea sunt poluate cu ape uzate ...... Bolile peștilor: un manual
Fier- (Ferrum) Fier metal, proprietăți ale metalului, obținere și aplicare Informații despre fier metal, fizice și Proprietăți chimice metal, minerit și utilizarea fierului Cuprins Cuprins Definiția termenului Etimologie Istoria fierului Originea ... ... Enciclopedia investitorului
Fier- 26 Mangan ← Fier → Cobalt ... Wikipedia
FIER- FIER, Ferrum (Fe), un metal greu aparținând grupei VIII sistem periodic Mendeleev. La. V. 55,84(0=16) și doi izotopi cu at. V. în 56 și 54. Zh. pură are o culoare alb-argintie; bate V. 7,88; este mai moale si mai ......
Fier- (tehnic) Zh. este cel mai comun și cel mai comun dintre metale. Zh. era cunoscut egiptenilor în timpul construcției piramidelor; grecii îl menționează în Iliada lui Homer și vorbesc despre el ca pe un metal greu de prelucrat, ... ...
Clorură de fier- Clorura ferică, FeCl3... Scurt Dicţionar pentru imprimare
Amalgamare- acesta este denumirea metodei miniere de extragere a argintului și aurului din minereuri și produse din fabrică folosind mercur. Există două moduri: american, sau amalgamare în grămezi, și european, sau amalgamare în butoaie. Prima a fost introdusă în Mexic de Bartolome ...... Dicţionar enciclopedic F. Brockhaus și I.A. Efron
Hidroliză- (chim.). G. sau, incorect, disocierea hidrolitică, este reacția de descompunere (cf. Deplasarea) prin apă a unui corp dizolvat în acesta (un sistem numit de obicei omogen) sau în contact cu soluție apoasă… … Dicţionar Enciclopedic F.A. Brockhaus și I.A. Efron
fiziologia plantelor- Conținut: Subiectul de nutriție F.F. F. creştere. F. forme ale plantelor. F. reproducere. Literatură. Fizica plantelor studiază procesele care au loc în plante. Această parte a vastei științe a plantelor botanice diferă de celelalte părți ale taxonomiei, ...... Dicţionar Enciclopedic F.A. Brockhaus și I.A. Efron
BESTUZHEVA PICĂTURI- BESTUZHEV DROPS, Tinct. ferri chlo rati aetherea, Spiritus aethereus ferratus (F VII), Tinct. nervina Bestuscheffi, propusă în 1725 de contele A.P. Bestuzhev Ryumin, B. to. reprezintă o soluție alcoolică de clorură ferică, supusă la ... ... Marea Enciclopedie Medicală