табиғи ақуыз. Нақты ақуыз туралы түсінік. Аллостериялық белоктар туралы түсінік. Сабақтың теориялық негіздері
Пептидтік байланыс белок молекуласының біріншілік құрылымының омыртқасын (омыртқасын) анықтайды және оған қаттылық береді.
Теориялық негізісыныптар
Белок молекуласының құрылымы
Сабақтың мақсаты:белок молекулаларының макромолекулярлық ұйымдасу түрлерін оқу.
Бастапқы құрылымбелоктар- полипептидтік тізбектегі (немесе тізбектердегі) аминқышқылдарының реттілігі және дисульфидтік байланыстардың орны (бар болса).
Біріншілік құрылым коваленттік байланыстармен тұрақталады: пептидтік байланыстар, ал кейбір пептидтерде дисульфидтік байланыстар.
Біріншілік құрылымның коваленттік байланыстарының бұзылуы – гидролиз: 1) қышқылдық – 6 н. HCl, 100-110 0 С, 24 сағат; 2) ферментативті – рН 1,5-5,0 кезінде асқазандағы протеолитикалық ферменттердің көмегімен – пепсин; трипсин, химотрипсин, карбоксипептидаза – он екі елі ішекте; дипептидазалар, трипептидазалар және аминопептидазалар – аш ішекте, рН 8,6.
Пептидтік байланыстың сипаттамасы. Пептидтік байланыс жазық (копланар) болып табылады. C-N байланысы p, π - конъюгация (С=О қос байланыстың π-электрондары бар атомның бос электрон жұбының конъюгациясы) есебінен қос байланысқа ұқсайды (айналу мүмкін емес).
Ақуыздың біріншілік құрылымындағы аминқышқылдарының реттілігі осы ақуызға тән ерекше түр.
Белоктың бастапқы құрылымы транскрипция және трансляция процестерінде генетикалық түрде анықталады және қайталанады.
Ақуыздың негізгі құрылымы кейінгі белок құрылымдарын қалыптастыру үшін негізгіполипептидтік тізбектің аминқышқылдары қалдықтарының радикалдарының өзара әрекеттесуіне байланысты.
L сериялы амин қышқылын D сериялы амин қышқылымен ауыстыру немесе тіпті бір L-амин қышқылын екіншісімен ауыстыру толық жоғалып кетуіне әкелуі мүмкін. биологиялық белсенділікпептид.
Физиологиялық белсенді пептидтер 3-тен 100-ге дейін аминқышқылдарының қалдықтары (ММ 6000 Да-дан төмен) бар. Белоктардан айырмашылығы, полипептидтерде протеиногенді емес немесе өзгертілген протеиногендік аминқышқылдары болуы мүмкін. Мысалдар:
1. Брадикинин мен каллидин тегіс бұлшықеттердің босаңсуын тудырады және спецификалық плазма а2-глобулиндер протеолизінің өнімдері болып табылады, сондықтан бұл пептидтердің құрамында тек протеиногенді аминқышқылдары бар:
брадикинин: arg-pro-pro-gly-phen-ser-pro-phen-arg;
Каллидин: Lys-arg-pro-pro-gli-phen-ser-pro-phen-arg.
2. Глутатион (γ-glu-cis-gli) барлық жасушаларда кездеседі. Ол аминқышқылдарының мембраналар арқылы тасымалдануы, бірқатар ферменттердің жұмысы үшін қажет. Ол дисульфидті байланыстарды сақтайды, глутамат α-амин тобы арқылы цистеинмен байланыспағанда, құрамында атипті пептидтік байланыс бар.
Ақуыз полиморфизмі- бұл біріншілік құрылымы, физика-химиялық қасиеттері және биологиялық белсенділік көріністері бойынша бір-бірінен ерекшеленетін бір белоктың бірнеше молекулалық формада болуы.
Белок полиморфизмінің себептері гендердің рекомбинациялары мен мутациялары болып табылады. Изопротеиндер - түр генофондында бірнеше құрылымдық гендердің болуы нәтижесінде бір түрге жататын организмдерде кездесетін белоктың бірнеше молекулалық формалары. Бірнеше гендер бірнеше аллельдер немесе бірнеше гендік локустар түрінде ұсынылуы мүмкін.
Белок полиморфизмінің мысалдары.
1. Филогенездегі белок полиморфизмі – әр түрдегі гомологты белоктардың болуы. Бұл белоктарда олардың қызметіне жауапты бірінші құрылымның аймақтары консервативті (өзгеріссіз) болып қалады. Адам ағзасындағы жоғалған белоктардың орнын толтыру үшін бастапқы құрылымында ең аз айырмашылықтар бар (ірі қара мал, шошқа, сперматозоид инсулині) жануарлардың гомологиялық ақуыздары қолданылады.
2. Онтогенездегі белоктардың полиморфизмі – организмнің өмірлік циклінің әртүрлі сегменттерінде гомологты белоктардың болуы. Ұрықта гемоглобин F бар (ұрықтың гемоглобині, α 2 γ 2, оттегіге жоғары жақындығы бар). Туылғаннан кейін ол гемоглобин А 1 (a 2 b 2) ауыстырылады.
3. Ұлпа ақуызының полиморфизмі. Әртүрлі жасушалардағы бірдей фермент бірдей реакцияны катализдейді, бірақ біріншілік құрылымында – изоферменттерде айырмашылықтар болады. Қандағы изоферменттерді анықтау белгілі бір тіннің зақымдалуын диагностикалауға көмектеседі.
4. Патологиядағы белок полиморфизмі. Тұқым қуалайтын мутациялардың бірнеше формаларының мысалын қарастырайық. Бұл жағдайда көбінесе қышқыл амин қышқылының негізгі немесе бейтараппен ауыстырылуы орын алады:
HbC-де β-тізбектегі глю 6-ның лизиспен алмастырылуы;
HbE-де β-тізбектегі глю 26-ны лизиспен ауыстыру;
HbI-де β-тізбектегі lys 16-ны asp-пен ауыстыру;
HbS-де β-тізбектегі глю 6-ны білікпен ауыстыру.
Соңғы жағдайда орақ жасушалы анемия сияқты ауру пайда болады. Аномальді гемоглобиндер қалыптыдан заряды және электрофоретикалық қозғалғыштығы бойынша ерекшеленеді. Гемоглобиндердің физика-химиялық өзгерістері оттегінің тасымалдануының бұзылуымен бірге жүреді.
Белоктың екіншілік құрылымы- сутектік байланыстармен тұрақтандырылған полипептидтік тізбектің жүйелі ұйымдастырылуы. Сутектік байланыстар пептидтік байланыстардың NH және CO топтары арасында түзіледі. а-спираль, b-құрылым және ретсіз конформация (орам) болады.
а-Спираль. Полипептидтік тізбектің бұралуы сағат тілімен (оң жақ спираль) жүреді, бұл L-аминқышқылдарының құрылымына байланысты. Спиральдың әрбір айналымы (қадамы) үшін 3,6 амин қышқылының қалдығы болады. Спираль қадамы 0,54 нм, амин қышқылы қалдығы үшін 0,15 нм. Спираль бұрышы 26 0. спиральдың әрбір 5 айналымы (18 амин қышқылы қалдығы) полипептидтік тізбектің құрылымы қайталанады. Сутектік байланыстар спираль осіне параллель және әрбір бірінші және әрбір бесінші амин қышқылы қалдықтарының арасында болады. А-спиральдың түзілуіне көлемді және зарядталған радикалдары бар пролин және аминқышқылдары кедергі жасайды.
Β-Құрылым. Фибриллярлы белоктарда екі немесе одан да көп сызықты полипептидтік тізбектер молекуланың осіне перпендикуляр сутектік байланыстармен тығыз байланысқан (бүктелген b қабаты). Егер екі полипептидтік тізбек N-тен С-соңғысына дейін бір бағытта жүретін тізбекаралық сутектік байланыстар арқылы қосылса, онда бұл параллель β-құрылым болады. Егер тізбектердің N- және С-ұштары қарама-қарсы болса, онда бұл антипараллельді b-құрылым. Егер бір полипептидтік тізбек иіліп, өзіне параллель жүрсе, онда бұл антипараллельді β-крест құрылымы. Тізбектің иілу орындары pro, gli, asn-b-bend арқылы анықталады.
ретсіз конформация. Ақуыз молекуласының бұрандалы немесе қатпарлы құрылымдарға жатпайтын бөлімдері ретсіз деп аталады. Графикалық кескінде спиральды бөліктер цилиндр түрінде, ал бүктелген құрылымдар жебемен бейнеленген. Екіншіден жоғары құрылым түсінігі ажыратылады, ол а-спиральді қималар мен b-құрылымдардың жүйелі кезектесуі болып табылады.
Үшіншілік құрылым- тұтастай полипептидтік тізбектің конформациясы (яғни үш өлшемді кеңістікте орналасуы). Үшіншілік құрылым полипептидтік тізбектің аминқышқылдары қалдықтарының радикалдары арасындағы байланыстар мен өзара әрекеттесу арқылы тұрақталады: коваленттік - дисульфидтік байланыс, сонымен қатар сутегі, иондық байланыстар және гидрофобты әрекеттесу. Үшіншілік құрылымы бар белоктардың түрлері:
а-спиральды кесінділері басым болатын белоктар шар тәрізді пішінге ие (глобулярлы белоктар) және динамикалық функцияларды орындайды;
бүктелген b қабатының құрылымдары басым болатын белоктар жіп тәрізді (фибриллярлы белоктар) пішінге ие және құрылымдық қызметтерді орындайды;
Коллаген - жануарлар әлемінде ең көп таралған ақуыз (барлық дене ақуыздарының 25% дейін), ерекше құрылымы бар. Коллаген (тропоколлаген) молекуласы үш полипептидтік тізбектен тұрады. Әрбір полипептидтік тізбекте 1000-ға жуық амин қышқылы қалдықтары бар (35% глицин, 21% пролин және гидроксипролин, 11% аланин). Әрбір полипептидтік тізбекте тығыз спираль конформациясы бар (бір айналымда 3 аминқышқылының қалдығы). Тропоколлаген молекуласында барлық үш спираль бір-бірімен араласып, жгут түзеді. Спиральдар арасында пептидтік топтар есебінен сутектік байланыстар түзіледі. Бұл құрылым коллаген талшықтарының беріктігін қамтамасыз етеді.
Нәруыз белок құрылымы.
Үшіншілік құрылымдағы көптеген белоктардың спираль тәрізді, қатпарлы және ретсіз сегменттері болады. Сонымен қатар функционалдық және құрылымдық жағынан аминқышқылдарының радикалдарының өзара орналасуы маңызды. Тұтыну келесі шарттар:
домендер – белоктың белгілі бір қызметін орындауға жауапты үшінші реттік құрылымының анатомиялық ерекшеленген аймақтары;
гидрофобты қалталар – гидрофобты амин қышқылы радикалдарымен қапталған үшінші құрылымдағы қуыстар; белок молекуласына гидрофобты лигандтарды батыруға қызмет етеді;
гидрофобты кластерлер – ақуыз бетінің гидрофобты аминқышқылдарының радикалдары шоғырланған аймақтары; басқа молекулалардың гидрофобты кластерлерімен әрекеттесу үшін қызмет етеді.
Белгілі бір функцияны орындау үшін ақуыздың белгілі бір және көбінесе жалғыз үшінші реттік құрылымы (конформациясы) - нативті құрылым болуы керек.
Күріш. 3.9. Лактоглобулиннің үшінші реттік құрылымы, типтік a/p ақуызы (PDB-200I сәйкес) (Браунлоу, С., Мараис Кабрал, Дж. Х., Купер, Р., Флюр, Д. Р., Юдалл, С. Дж., Поликарпов, И., Солтүстік, А. С. , Сойер , Л.: Құрылым, 5, 481 б. 1997)
Кеңістіктік құрылым полипептидтік тізбектің ұзындығына байланысты емес, әрбір ақуызға тән аминқышқылдары қалдықтарының реттілігіне, сондай-ақ сәйкес аминқышқылдарына тән бүйірлік радикалдарға байланысты. Ақуыз макромолекулаларының кеңістіктік үш өлшемді құрылымы немесе конформациясы ең алдымен сутегі байланыстарымен, сондай-ақ аминқышқылдарының полярлы емес бүйірлік радикалдары арасындағы гидрофобты әрекеттесулер арқылы қалыптасады. Сутегі байланыстары ойнайды үлкен рөлбелок макромолекуласының кеңістіктік құрылымын қалыптастыруда және ұстауда. Осы атомдардың бірімен ковалентті байланысқан сутегі протоны арқылы екі электртеріс атомдар арасында сутектік байланыс түзіледі. Электрон жұбының түзілуіне сутегі атомының жалғыз электроны қатысқанда, протон көрші атомға тартылып, сутектік байланыс түзеді. Сутектік байланыстың түзілуінің алғы шарты – электронтеріс атомда кем дегенде бір бос электрон жұбының болуы. Гидрофобты әрекеттесулерге келетін болсақ, олар белок глобулының бетіне ығысқан су молекулалары арасындағы сутектік байланыстарды үзуге қабілетсіз полярлы емес радикалдар арасындағы жанасу нәтижесінде пайда болады. Ақуызды синтездеу кезінде полярлы емес химиялық топтар глобулдың ішінде жиналады, ал полярлылар оның бетіне күшпен сыртқа шығарылады. Осылайша, ақуыз молекуласыеріткіштің рН мәніне және белоктағы иондық топтарға байланысты бейтарап, оң зарядты немесе теріс зарядты болуы мүмкін. Әлсіз әрекеттесулерге иондық байланыстар мен ван-дер-Ваальс әрекеттесулері де жатады. Сонымен қатар, белоктардың конформациясы ковалент арқылы сақталады S-S байланыстарыекі цистеин қалдығы арасында түзіледі. Гидрофобты және гидрофильді әрекеттесу нәтижесінде белок молекуласы термодинамикалық жағынан ең қолайлы конформациялардың біреуін немесе бірнешеуін өздігінен қабылдайды, ал егер қандай да бір сыртқы әсерлердің нәтижесінде нативті конформация бұзылса, оның толық немесе толық дерлік қалпына келуі мүмкін. Мұны алғаш рет К.Анфинсен каталитикалық белсенді протеин рибонуклеазасын мысал ретінде көрсетті. Мочевина немесе р-меркаптоэтанол әсер еткенде оның конформациясы өзгеретіні және нәтижесінде каталитикалық белсенділіктің күрт төмендеуі орын алатыны анықталды. Мочевинаның жойылуы белок конформациясының бастапқы күйіне өтуіне әкеледі, каталитикалық белсенділік қалпына келеді.
Сонымен, белоктардың конформациясы үш өлшемді құрылым болып табылады және оның түзілуі нәтижесінде полипептидтік тізбектің шалғай бөлімдерінде орналасқан көптеген атомдар бір-біріне жақындайды және бір-біріне әсер ете отырып, жеке аминоларда жоқ жаңа қасиеттерге ие болады. қышқылдар немесе ұсақ полипептидтер. Бұл деп аталатын үшінші құрылым, кеңістікте полипептидтік тізбектердің бағдарлануымен сипатталады (3.9-сурет). Глобулярлы және фибриллярлы белоктардың үшінші реттік құрылымы бір-бірінен айтарлықтай ерекшеленеді. Ақуыз молекуласының формасын асимметрия дәрежесі сияқты көрсеткішпен сипаттау әдеттегідей (молекуланың ұзын осінің қысқаға қатынасы). Глобулярлы белоктарда ассиметрия дәрежесі 3-5, фибриллярлық белоктар үшін бұл көрсеткіш әлдеқайда жоғары (80-ден 150-ге дейін).
Олай болса, бастапқы және қайталама қатпарлы құрылымдар қатпарлы, жоғары тұрақты түрге қалай айналады? Есептеулер көрсеткендей, ақуыздардың үш өлшемді құрылымдарын қалыптастыру үшін теориялық мүмкін болатын комбинациялар саны табиғатта нақты барларға қарағанда өлшеусіз көп. Шамасы, ең энергетикалық қолайлы формалар конформациялық тұрақтылықтың негізгі факторы болып табылады.
Балқыған глобул гипотезасы. Полипептидтік тізбектің үш өлшемді құрылымға қатпарлануын зерттеу әдістерінің бірі белок молекуласының денатурациясы және одан кейінгі ресатурациясы болып табылады.
К.Анфинсеннің рибонуклеазамен жүргізген тәжірибелері денатурация нәтижесінде бұзылған кеңістіктік құрылымды дәл құрастыру мүмкіндігін анық көрсетеді (3.10-сурет).
Бұл жағдайда нативті конформацияны қалпына келтіру ешқандай қосымша құрылымдардың болуын талап етпейді. Полипептидтік тізбекті сәйкес конформацияға қайырудың қандай үлгілері ең ықтимал? Белоктың өздігінен ұйымдастырылуы туралы кең таралған гипотезалардың бірі балқытылған глобул гипотезасы болып табылады. Осы концепция шеңберінде белоктың өздігінен жиналуының бірнеше кезеңдері ажыратылады.
- 1. Қатпарланбаған полипептидтік тізбекте сутектік байланыстар мен гидрофобты әрекеттесулердің көмегімен толық екіншілік және суперекіншілік құрылымдардың түзілуіне дән ретінде қызмет ететін екінші реттік құрылымның жеке бөлімдері түзіледі.
- 2. Бұл учаскелердің саны белгілі бір шекті мәнге жеткенде, бүйірлік радикалдар қайта бағытталады және полипептидтік тізбек жаңа, неғұрлым ықшам формаға өтеді және ковалентті емес байланыстар саны.

Күріш. 3.10.
айтарлықтай артады. Бұл кезеңге тән қасиет полипептидтік тізбектің шалғай жерлерінде орналасқан, бірақ үшінші реттік құрылымның қалыптасуы нәтижесінде жақын болып шыққан атомдар арасында ерекше байланыстардың пайда болуы болып табылады.
3. Соңғы кезеңде дисульфидті байланыстың тұйықталуымен және белок конформациясының соңғы тұрақтануымен байланысты белок молекуласының нативті конформациясы қалыптасады. Арнайы емес жинақтау да жоққа шығарылмайды.
полипстидтік тізбектер, олар нативті ақуыздарды қалыптастырудағы қателер ретінде жіктелуі мүмкін. Ішінара бүктелген полипептидтік тізбек (қадам 2) балқытылған глобул, және сатысы деп аталады 3 жетілген белоктың ең баяу түзілуі болып табылады.
Суретте. 3.11 бір генмен кодталған белок макромолекуласының түзілу нұсқасын көрсетеді. Белгілі болғанымен, бірқатар ақуыздар доменге ие

Күріш. 3.11.
(Н.К. Наградова бойынша) nuyu құрылымы, гендердің қосарлануы нәтижесінде қалыптасады және жеке домендер арасындағы байланыстардың қалыптасуы қосымша күш салуды қажет етеді. Жасушаларда жаңадан синтезделген белоктардың қатпарлануын реттейтін арнайы механизмдер бар екені анықталды. Қазіргі уақытта бұл механизмдерді жүзеге асыруға қатысатын екі фермент анықталды. Полипептидтік тізбектердің қатпарлануының үшінші сатысының баяу реакцияларының бірі * 
Күріш. 3.12.
Сонымен қатар, жасушаларда бірқатар каталитикалық белсенді емес ақуыздар бар, соған қарамастан олар белоктардың кеңістіктік құрылымдарының қалыптасуына үлкен үлес қосады. Бұлар шаперондар мен шаперониндер деп аталады (3.12-сурет). Молекулярлық шаперондарды ашушылардың бірі Л.Эллис оларды in vivo құрамында полипептидтері бар басқа құрылымдардың ковалентті емес дұрыс жинақталуына көмектесетін, бірақ құрамына кірмейтін, бір-бірімен байланысы жоқ ақуыз тұқымдасының функционалдық класы деп атайды. жинақталған құрылымдар және олардың қалыпты физиологиялық функцияларын жүзеге асыруға қатыспайды.
Шаперондар функционалдық белсенді емес ақуыз құрылымдарының түзілуіне әкелетін ақаулы байланыстарды тежей отырып, ішінара бүктелген полипептидтік тізбегі бар қайтымды, ковалентті емес кешендерді құру арқылы үш өлшемді ақуыз конформациясын дұрыс құрастыруға көмектеседі. Шаперондарға тән функциялар тізбесі балқыған глобулдарды агрегациядан қорғауды, сондай-ақ жаңадан синтезделген ақуыздарды әртүрлі жасуша локустарына тасымалдауды қамтиды. Шаперондар негізінен жылу соққысының ақуыздары болып табылады, олардың синтезі стресстік температура әсерінен күрт артады, сондықтан оларды hsp (жылу соққысының ақуыздары) деп те атайды. Бұл белоктардың тұқымдасы микробтардың, өсімдіктердің және жануарлардың жасушаларында кездеседі. Шаперондардың жіктелуі оларға негізделген молекулалық салмақ, ол 10-нан 90 кДа-ға дейін өзгереді. Жалпы, шаперондар мен шаперониндердің қызметтері ерекшеленеді, бірақ олардың екеуі де белоктардың үш өлшемді құрылымын қалыптастыру процестерінде көмекші белоктар болып табылады. Шаперондар жаңадан синтезделген полипептидтік тізбекті қатпарланбаған күйде сақтайды, оның нативті түрінен басқа пішінге айналуын болдырмайды, ал шаперониндер жалғыз дұрыс, нативті белок құрылымының қалыптасуына жағдай жасайды (3.13-сурет).

Күріш. 3.13.
Шаперондар / рибосомадан түсетін нұрлы полипептидтік тізбекпен байланысты. Полипептидтік тізбек түзіліп, оны рибосомадан босатқаннан кейін шаперондар онымен байланысып, агрегацияны болдырмайды. 2. Цитоплазмада қатпарланғаннан кейін белоктар шапероннан бөлініп, сәйкес шаперонинге ауысады, онда үшінші реттік құрылымның соңғы түзілуі жүреді. 3. Цитозолдық шаперонның көмегімен белоктар митохондрияның сыртқы қабығына ауысады, онда митохондриялық шаперон оларды митохондрияның ішіне тартады және оларды митохондриялық шаперонинге «береді», онда қатпарлану жүреді. 4, және 5 ұқсас 4 , бірақ эндоплазмалық ретикулумға қатысты.
1-МОДУЛЬ НЕГІЗДІҢ ҚҰРЫЛЫМЫ, ҚАСИЕТТЕРІ ЖӘНЕ ҚЫЗМЕТІ
1-МОДУЛЬ НЕГІЗДІҢ ҚҰРЫЛЫМЫ, ҚАСИЕТТЕРІ ЖӘНЕ ҚЫЗМЕТІ
Модуль құрылымы | Тақырыптар |
Модульдік блок 1 | 1.1. Белоктардың құрылымдық ұйымдасуы. Белоктардың нативті конформациясының қалыптасу кезеңдері 1.2. Белоктардың қызмет ету негіздері. Белок қызметіне әсер ететін лигандтар ретіндегі препараттар 1.3. Белоктардың денатурациясы және олардың өздігінен ренатациялану мүмкіндігі |
Модульдік блок 2 | 1.4. Гемоглобин мысалында олигомерлі белоктардың құрылысы мен қызметінің ерекшеліктері 1.5. Жасушадағы белоктардың нативті конформациясын сақтау 1.6. Белоктардың әртүрлілігі. Иммуноглобулиндер мысалында белоктар тұқымдастары 1.7. Белоктардың физика-химиялық қасиеттері және оларды бөлу әдістері |
Модульдік блок 1 МОНОМЕРЛІ БЕЛГІЛЕРДІҢ ҚҰРЫЛЫМДЫҚ ҰЙЫМДАСТЫРЫЛУЫ ЖӘНЕ ОЛАРДЫҢ ҚЫЗМЕТІНІҢ НЕГІЗДЕРІ
Оқу мақсаттары Істей білу:
1. Тұқым қуалайтын және жүре пайда болған протеинопатиялардың даму механизмдерін түсіну үшін белоктардың құрылымдық ерекшеліктері және белок функцияларының олардың құрылымына тәуелділігі туралы білімдерін пайдалану.
2. Белоктармен әрекеттесіп, белсенділігін өзгертетін лигандтар ретіндегі кейбір дәрілік заттардың емдік әсер ету механизмдерін түсіндіріңіз.
3. Белоктардың құрылымы мен конформациялық лабильділігі туралы білімдерін олардың құрылымдық және функционалдық тұрақсыздығын және өзгермелі жағдайларда денатурацияға бейімділігін түсіну үшін пайдаланыңыз.
4. Медициналық материал мен аспаптарды, сондай-ақ антисептиктерді зарарсыздандыру құралы ретінде денатурациялаушы заттарды қолдануды түсіндіріңіз.
Білу:
1. Белоктардың құрылымдық ұйымдасу деңгейлері.
2. Белоктардың құрылымдық және қызметтік әртүрлілігін анықтайтын біріншілік құрылымының маңызы.
3. Белоктардағы белсенді орталықтың түзілу механизмі және оның белоктар қызметінің негізінде жатқан лигандпен спецификалық әсерлесуі.
4. Экзогендік лигандтардың (дәрілік заттар, токсиндер, улар) белоктардың конформациясы мен функционалдық белсенділігіне әсер ету мысалдары.
5. Белок денатурациясының себептері мен салдары, денатурацияны тудыратын факторлар.
6. Медицинада денатурациялаушы факторларды антисептиктер және медициналық аспаптарды зарарсыздандыруға арналған құралдар ретінде қолдану мысалдары.
ТАҚЫРЫП 1.1. БЕЛГІЛЕРДІҢ ҚҰРЫЛЫМДЫҚ ҰЙЫМДАСТЫРЫЛУЫ. ТУҒАН ТҰРҒАНЫН ҚАЛЫПТАСТЫРУ КЕЗЕҢДЕРІ
ПРОТЕИНДІҢ КОНФОРМАЦИЯЛАРЫ
Белоктар полимерлі молекулалар, олардың мономерлері тек 20 α-аминқышқылдары. Белоктағы амин қышқылдарының жиынтығы мен байланысу реті даралардың ДНҚ-дағы гендердің құрылымымен анықталады. Әрбір белок өзінің ерекше құрылымына сәйкес өз қызметін атқарады. Белгілі бір организмнің белоктарының жиынтығы оның фенотиптік ерекшеліктерін, сондай-ақ тұқым қуалайтын аурулардың болуын немесе олардың дамуына бейімділігін анықтайды.
1. Белоктарды құрайтын аминқышқылдары. пептидтік байланыс.Белоктар – мономерлерден – 20 α-аминқышқылдарынан түзілген полимерлер, олардың жалпы формуласы:
Аминқышқылдары α-көміртек атомына қосылған радикалдардың құрылымы, мөлшері, физика-химиялық қасиеттері бойынша ерекшеленеді. Аминқышқылдарының функционалдық топтары әртүрлі α-аминқышқылдарының қасиеттерінің ерекшеліктерін анықтайды. α-аминқышқылдарының құрамындағы радикалдарды бірнеше топқа бөлуге болады:
пролин,Басқа 19 ақуыз мономерлерінен айырмашылығы, амин қышқылы емес, иминоқышқыл, пролиндегі радикал α-көміртек атомымен де, имино тобымен де байланысты.
 Аминқышқылдары суда ерігіштігімен ерекшеленеді.Бұл радикалдардың сумен әрекеттесу қабілетіне (гидратациялануға) байланысты.
Аминқышқылдары суда ерігіштігімен ерекшеленеді.Бұл радикалдардың сумен әрекеттесу қабілетіне (гидратациялануға) байланысты.
TO гидрофильдіқұрамында аниондық, катиондық және полярлық зарядсыз радикалдар жатады функционалдық топтар.
TO гидрофобтықұрамында метил топтары, алифаттық тізбектер немесе циклдар бар радикалдар жатады.
2. Пептидтік байланыс аминқышқылдарын пептидтерге байланыстырады.Пептид синтезі кезінде бір амин қышқылының α-карбоксил тобы екінші амин қышқылының α-амин тобымен әрекеттеседі. пептидтік байланыс:
Белоктар полипептидтер, яғни. байланысқан α-аминқышқылдарының сызықтық полимерлері пептидтік байланыс(Cурет 1.1.)
 Күріш. 1.1. Пептидтердің құрылысын сипаттауда қолданылатын терминдер
Күріш. 1.1. Пептидтердің құрылысын сипаттауда қолданылатын терминдер
Полипептидтерді құрайтын аминқышқылдарының мономерлері деп аталады аминқышқылдарының қалдықтары.Қайталанатын топтар тізбегі - NH-CH-CO- пішіндер пептидтік магистраль.Бос α-амин тобы бар аминқышқылдарының қалдығы N-терминал деп аталады, ал бос α-карбоксил тобы бар аминқышқылдарының қалдығы С-терминал деп аталады. Пептидтер N-терминусынан С-соңына дейін жазылады және оқылады.
Пролиннің имино тобынан түзілетін пептидтік байланыс басқа пептидтік байланыстардан ерекшеленеді: пептидтік топтың азот атомында сутегі,
оның орнына радикалмен байланыс бар, нәтижесінде циклдің бір жағы пептидтік магистральға кіреді:
 Пептидтер аминқышқылдарының құрамымен, аминқышқылдарының санымен және аминқышқылдарының орналасу ретімен ерекшеленеді, мысалы, Ser-Ala-Glu-Gis және His-Glu-Ala-Ser екі түрлі пептидтер.
Пептидтер аминқышқылдарының құрамымен, аминқышқылдарының санымен және аминқышқылдарының орналасу ретімен ерекшеленеді, мысалы, Ser-Ala-Glu-Gis және His-Glu-Ala-Ser екі түрлі пептидтер.
Пептидтік байланыстар өте күшті және олардың химиялық ферментативті емес гидролизі үшін қатал жағдайлар қажет: талданатын ақуыз концентрлі тұз қышқылында шамамен 110°С температурада 24 сағат бойы гидролизденеді. Тірі жасушада пептидтік байланыстарды бұзуға болады протеолитикалық ферменттер,шақырды протеазаларнемесе пептидті гидролазалар.
3. Белоктардың біріншілік құрылымы.Әртүрлі белоктардың пептидтік тізбектеріндегі аминқышқылдарының қалдықтары ретсіз кезектеспей, белгілі бір ретпен орналасады. Полипептидтік тізбектегі аминқышқылдары қалдықтарының сызықтық тізбегі немесе тізбегі деп аталады. белоктың бастапқы құрылымы.
Әрбір жеке ақуыздың бастапқы құрылымы ДНҚ молекуласында (ген деп аталатын аймақта) кодталған және транскрипция (мРНҚ туралы ақпаратты қайта жазу) және трансляция (ақуыздың бастапқы құрылымының синтезі) кезінде жүзеге асырылады. Демек, жеке адамның белоктарының бастапқы құрылымы ата-анадан балаларға мұра болып табылатын ақпарат болып табылады, ол белгілі бір ағзаның белоктарының құрылымдық ерекшеліктерін анықтайды, оған бар белоктардың қызметі байланысты болады (1.2-сурет).
 Күріш. 1.2. Жеке адам ағзасында синтезделген белоктардың генотипі мен конформациясы арасындағы байланыс
Күріш. 1.2. Жеке адам ағзасында синтезделген белоктардың генотипі мен конформациясы арасындағы байланыс
Адам ағзасындағы шамамен 100 000 жеке белоктың әрқайсысында бар бірегейбастапқы құрылым. Белоктың бір түрінің молекулалары (мысалы, альбумин) альбуминді кез келген басқа жеке белоктан ерекшелендіретін аминқышқылдарының қалдықтарының бірдей кезектесуіне ие.
Пептидтік тізбектегі аминқышқылдары қалдықтарының реттілігін ақпаратты тіркеу формасы ретінде қарастыруға болады. Бұл ақпарат сызықтық пептидтік тізбектің кеңістіктік қатпарлануын анықтайды, үш өлшемді құрылым деп аталады. конформациятиін. Функционалды белсенді белок конформациясының түзілу процесі деп аталады бүктеу.
4. Белоктардың конформациясы.Пептидтік магистральда еркін айналу пептидтік топтың азот атомы мен көршілес α-көміртек атомы арасында, сондай-ақ α-көміртек атомы мен карбонил тобы көміртегі арасында мүмкін. Аминқышқылдары қалдықтарының функционалдық топтарының өзара әрекеттесуіне байланысты белоктардың біріншілік құрылымы күрделірек кеңістіктік құрылымдарға ие болуы мүмкін. Глобулярлы белоктарда пептидтік тізбектердің конформациясының қатпарлануының екі негізгі деңгейі бөлінеді: қосалқыЖәне үшінші құрылым.
Белоктардың екіншілік құрылымы- бұл пептидтік магистральдың -C=O және -NH- функционалдық топтары арасында сутектік байланыстардың түзілуі нәтижесінде түзілетін кеңістіктік құрылым. Бұл жағдайда пептидтік тізбек екі типті тұрақты құрылымдарды ала алады: α-спиральдарЖәне β құрылымдар.
IN α-спиральдаркарбонил тобының оттегі атомы мен одан 4-ші амин қышқылының амидті азотының сутегі арасында сутектік байланыстар түзіледі; амин қышқылы қалдықтарының бүйірлік тізбектері
екінші реттік құрылымның түзілуіне қатыспай, спиральдың шеткі жағында орналасқан (1.3-сурет).
Бірдей зарядты алып жүретін көлемді радикалдар немесе радикалдар α-спиралдың түзілуіне жол бермейді. Сақина құрылымы бар пролин қалдығы α-спиралды үзеді, өйткені пептидтік тізбектегі азот атомында сутегінің болмауына байланысты сутегі байланысын құру мүмкін емес. Азот пен α-көміртек атомы арасындағы байланыс пролиндік циклдің бөлігі болып табылады, сондықтан пептидтік магистраль осы жерде иілуге ие болады.
β-құрылымыбір полипептидтік тізбектің пептидтік магистралінің сызықтық аймақтары арасында түзіледі, осылайша қатпарлы құрылымдарды құрайды. Полипептидтік тізбектер немесе олардың бөліктері түзілуі мүмкін параллельнемесе параллельге қарсы β-құрылымдар.Бірінші жағдайда әрекеттесетін пептидтік тізбектердің N- және С-терминалдары сәйкес келеді, ал екінші жағдайда олар қарама-қарсы бағытта болады (1.4-сурет).
Күріш. 1.3. Белоктың екінші реттік құрылымы – α-спираль
 Күріш. 1.4. Параллельді және антипараллельді β бүктемелі құрылымдар
Күріш. 1.4. Параллельді және антипараллельді β бүктемелі құрылымдар
β-құрылымдар кең көрсеткілермен белгіленеді: A - антипараллель β-құрылым. B - параллель β-бүрмеленген құрылымдар
Кейбір белоктарда β-құрылымдар әртүрлі полипептидтік тізбектердің пептидтік магистраль атомдары арасында сутектік байланыстардың түзілуіне байланысты түзілуі мүмкін.
Ақуыздарда да кездеседі тұрақты емес қайталама аймақтарқұрылым, оның құрамына полипептидті омыртқаның иілісі, ілмектері, бұрылыстары кіреді. Олар көбінесе пептидтік тізбектің бағыты өзгеретін жерлерде орналасады, мысалы, параллель β-парақ құрылымын қалыптастыру кезінде.
α-спиральдар мен β-құрылымдардың болуы бойынша глобулярлы белоктарды төрт категорияға бөлуге болады.
Күріш. 1.5. Миоглобин (А) мен гемоглобин β-тізбегінің (В) екінші реттік құрылымы, құрамында сегіз α-спираль бар
 Күріш. 1.6. Триозафосфат изомераза және пируваткиназа доменінің қайталама құрылымы
Күріш. 1.6. Триозафосфат изомераза және пируваткиназа доменінің қайталама құрылымы
 Күріш. 1.7. Иммуноглобулиннің тұрақты доменінің (А) және супероксид дисмутаза ферментінің (В) қайталама құрылымы
Күріш. 1.7. Иммуноглобулиннің тұрақты доменінің (А) және супероксид дисмутаза ферментінің (В) қайталама құрылымы
IN төртінші санатқұрамында қалыпты қайталама құрылымдардың аз мөлшері бар белоктар кіреді. Бұл белоктар құрамында цистеинге бай шағын ақуыздар немесе металлопротеидтер.
Ақуыздың үшінші реттік құрылымы- пептидтік тізбекте бір-бірінен едәуір қашықтықта орналасуы мүмкін аминқышқылдарының радикалдары арасындағы өзара әрекеттесу нәтижесінде түзілетін конформация түрі. Бұл жағдайда белоктардың көпшілігі шар тәрізді (глобулярлы белоктар) кеңістіктік құрылымды құрайды.
Өйткені аминқышқылдарының гидрофобты радикалдары деп аталатындар көмегімен біріктіруге бейім гидрофобты әрекеттесулержәне молекулааралық ван-дер-Ваальс күштерінің әсерінен белок шарының ішінде тығыз гидрофобты өзек түзіледі. Гидрофильді иондалған және иондалмаған радикалдар негізінен белоктың бетінде орналасады және оның суда ерігіштігін анықтайды.
 Күріш. 1.8. Ақуыздың үшінші реттік құрылымының түзілуі кезінде аминқышқылдарының радикалдары арасында пайда болатын байланыс түрлері
Күріш. 1.8. Ақуыздың үшінші реттік құрылымының түзілуі кезінде аминқышқылдарының радикалдары арасында пайда болатын байланыс түрлері
1 - иондық байланыс- оң және теріс зарядталған функционалдық топтар арасында пайда болады;
2 - сутектік байланыс- гидрофильді зарядсыз және кез келген басқа гидрофильді топ арасында кездеседі;
3 - гидрофобты әрекеттесулер- гидрофобты радикалдар арасында пайда болады;
4 - дисульфидтік байланыс- цистеин қалдықтарының SH-топтарының тотығуы және олардың бір-бірімен әрекеттесуі нәтижесінде түзіледі.
Гидрофобты ядродағы гидрофильді аминқышқылдарының қалдықтары бір-бірімен әрекеттесе алады иондықЖәне сутектік байланыстар(1.8-сурет).
Иондық және сутектік байланыстар, сондай-ақ гидрофобты өзара әрекеттесулер әлсіздер қатарына жатады: олардың энергиясы молекулалардың жылулық қозғалысының энергиясынан сәл асып түседі. бөлме температурасы. Ақуыз конформациясы осындай көптеген әлсіз байланыстардың пайда болуымен сақталады. Ақуызды құрайтын атомдар тұрақты қозғалыста болғандықтан, кейбір әлсіз байланыстарды үзіп, басқаларын түзуге болады, бұл полипептидтік тізбектің жеке бөлімдерінің шағын қозғалыстарына әкеледі. Белоктардың кейбірін үзіп, басқа әлсіз байланыстар түзу нәтижесінде конформациясын өзгерту қасиеті деп аталады конформациялық лабильділік.
Адам ағзасында қолдау көрсететін жүйелер бар гомеостаз- сау организм үшін қолайлы белгілі бір шектерде ішкі ортаның тұрақтылығы. Гомеостаз жағдайында конформацияның аздаған өзгерістері бұзылмайды жалпы құрылымжәне белоктардың қызметі. Белоктың функционалдық белсенді конформациясы деп аталады жергілікті конформация.Ішкі ортаның өзгеруі (мысалы, глюкоза, Са иондары, протондар және т.б. концентрациясы) белоктардың конформациясының өзгеруіне және функцияларының бұзылуына әкеледі.
Кейбір белоктардың үшінші реттік құрылымы тұрақтанады дисульфидті байланыстар,екі қалдықтың -SH топтарының әрекеттесуінен түзілген
 Күріш. 1.9. Белок молекуласында дисульфидті байланыстың түзілуі
Күріш. 1.9. Белок молекуласында дисульфидті байланыстың түзілуі
цистеин (1.9-сурет). Жасушаішілік белоктардың көпшілігінде үшінші реттік құрылымында ковалентті дисульфидтік байланыстар болмайды. Олардың болуы жасушадан бөлінетін белоктарға тән, бұл олардың жасушадан тыс жағдайларда үлкен тұрақтылығын қамтамасыз етеді. Сонымен, дисульфидті байланыстар инсулин мен иммуноглобулиндердің молекулаларында болады.
Инсулин- ұйқы безінің β-жасушаларында синтезделетін және қандағы глюкоза концентрациясының жоғарылауына жауап ретінде қанға бөлінетін ақуыздық гормон. Инсулиннің құрылымында полипептидті А- және В-тізбектерін байланыстыратын екі дисульфидтік байланыс және А-тізбектің ішінде бір дисульфидті байланыс бар (1.10-сурет).
 Күріш. 1.10. Инсулин құрылымындағы дисульфидті байланыстар
Күріш. 1.10. Инсулин құрылымындағы дисульфидті байланыстар
5. Белоктардың суперекінші реттік құрылымы.Белоктарда бастапқы құрылымы мен қызметтері әртүрлі, кейде ұқсас комбинациялар және қайталама құрылымдардың интерпозициясы,олар екіншіден жоғары құрылым деп аталады. Ол екінші және үшінші құрылымдар арасында аралық орынды алады, өйткені ол белоктың үшінші реттік құрылымын қалыптастыру кезінде екінші реттік құрылым элементтерінің белгілі бір жиынтығы болып табылады. Суперекіншілік құрылымдардың арнайы атаулары бар, мысалы, «α-спираль-бұрылу-а-спираль», «лейцин сыдырмасы», «мырыш саусақтары» және т.б. Мұндай суперекіншілік құрылымдар ДНҚ-байланыстырушы ақуыздарға тән.
«Лейцин найзағай».Бұл супер қосалқы құрылым екі ақуызды қосу үшін қолданылады. Әрекеттесетін белоктардың бетінде кемінде төрт лейцин қалдығы бар α-спиральді аймақтар бар. α-спиральдағы лейцин қалдықтары бір-бірінен алты аминқышқылдарынан алшақ орналасқан. α-спиральдың әрбір айналымында 3,6 амин қышқылы қалдықтары болғандықтан, әрбір екінші айналымның бетінде лейцин радикалдары кездеседі. Бір ақуыздың α-спиралының лейцин қалдықтары басқа белоктың лейцин қалдықтарымен әрекеттесе алады (гидрофобты әрекеттесу), оларды бір-бірімен байланыстырады (1.11. сурет). Көптеген ДНҚ-байланыстырушы белоктар олигомерлік кешендердің бөлігі ретінде қызмет етеді, мұнда жеке суббірліктер бір-бірімен «лейцин сыдырмалары» арқылы байланысқан.
 Күріш. 1.11. Екі ақуыздың α-спиральді аймақтары арасындағы «лейцин сыдырмасы».
Күріш. 1.11. Екі ақуыздың α-спиральді аймақтары арасындағы «лейцин сыдырмасы».
Гистондар осындай белоктардың мысалы болып табылады. Гистондар- ядролық белоктар, соның ішінде көп саныоң зарядталған аминқышқылдары – аргинин және лизин (80%-ға дейін). Гистон молекулалары осы молекулалардың айтарлықтай омонимдік зарядына қарамастан «лейцинді бекіткіштердің» көмегімен сегіз мономерден тұратын олигомерлік кешендерге біріктіріледі.
«Мырыш саусақ»- ДНҚ-байланыстырушы белоктарға тән суперекіншілік құрылымның нұсқасы белок бетінде ұзартылған фрагмент түрінде болады және құрамында 20-ға жуық амин қышқылы қалдықтары болады (1.12-сурет). «Созылған саусақтың» пішіні төрт амин қышқылы радикалымен - екі цистеин қалдығы және екі гистидин қалдығымен байланысты мырыш атомымен қамтамасыз етіледі. Кейбір жағдайларда гистидин қалдықтарының орнына цистеин қалдықтары болады. Бір-біріне жақын орналасқан екі цистеин қалдығы қалған екі Gisili қалдықтарынан шамамен 12 амин қышқылы қалдықтарынан тұратын Cys тізбегі арқылы бөлінеді. Ақуыздың бұл аймағы α-спиралды құрайды, оның радикалдары ДНҚ негізгі ойығының реттеуші аймақтарымен арнайы байланыса алады. Жеке тұлғаның байланыстыру ерекшелігі
 Күріш. 1.12. «Мырыш саусақ» құрылымын құрайтын ДНҚ-байланыстырушы белоктар бөлімінің бастапқы құрылымы (әріптер осы құрылымды құрайтын аминқышқылдарын көрсетеді)
Күріш. 1.12. «Мырыш саусақ» құрылымын құрайтын ДНҚ-байланыстырушы белоктар бөлімінің бастапқы құрылымы (әріптер осы құрылымды құрайтын аминқышқылдарын көрсетеді)
реттеуші ДНҚ-байланыстырушы протеин «мырыш саусақта» орналасқан аминқышқылдарының қалдықтарының реттілігіне байланысты. Мұндай құрылымдарда, атап айтқанда, транскрипцияны (ДНҚ-дан РНҚ-ға ақпаратты оқу) реттеуге қатысатын стероидты гормондардың рецепторлары бар.
ТАҚЫРЫП 1.2. НЕГІЗДЕРДІҢ ҚЫЗМЕТ КӨРСЕТУІНІҢ НЕГІЗДЕРІ. ПРОТЕИНДІҢ ҚЫЗМЕТІНЕ ӘСЕР ЕТЕТІН ЛИГАНД РЕТІНДЕГІ ДӘРІЛЕР
1. Белоктың активті орталығы және оның лигандпен әрекеттесуі.Үшiншiлiк құрылымның түзiлуi кезiнде функционалдық белсендi белоктың бетiнде, әдетте, ойыстан, бiрiншiлiк құрылымында бiр-бiрiнен алшақ жатқан аминқышқылдарының радикалдары түзетiн орын пайда болады. Белгілі бір ақуыз үшін бірегей құрылымға ие және белгілі бір молекуламен немесе ұқсас молекулалар тобымен арнайы әрекеттесе алатын бұл учаске лигандпен немесе белсенді учаскемен ақуызды байланыстыратын орын деп аталады. Лигандалар - белоктармен әрекеттесетін молекулалар.
Жоғары ерекшелікАқуыздың лигандпен әрекеттесуі активті орталықтың құрылымының лиганд құрылымымен комплементарлы болуымен қамтамасыз етіледі.
толықтыруәрекеттесетін беттердің кеңістіктік және химиялық сәйкестігі болып табылады. Белсенді орталық оның құрамына кіретін лигандаға кеңістіктік сәйкес ғана емес, сонымен қатар белсенді орталыққа кіретін радикалдардың функционалдық топтары мен лиганд арасында лигандты ұстап тұратын байланыстар (иондық, сутегі және гидрофобты әрекеттесулер) түзілуі керек. белсенді орталықта (Cурет 1.13 ).
 Күріш. 1.13. Белоктың лигандпен комплементарлы әрекеттесуі
Күріш. 1.13. Белоктың лигандпен комплементарлы әрекеттесуі
Кейбір лигандтар белоктың белсенді орталығына қосылған кезде белоктардың қызметінде көмекші рөл атқарады. Мұндай лигандтарды кофакторлар, ал құрамында белок емес бөлігі бар белоктар деп аталады. күрделі белоктар(тек протеин бөлігінен тұратын қарапайым белоктардан айырмашылығы). Ақуызға мықтап бекітілген белоксыз бөлік деп аталады протездік топ.Мысалы, миоглобин, гемоглобин және цитохромдардың құрамында белсенді орталыққа мықтап бекітілген протездік топ – құрамында темір ионы бар гем бар. Құрамында гем бар күрделі белоктар гемопротеидтер деп аталады.
Белгілі лигандтар белоктарға қосылғанда бұл белоктардың қызметі көрінеді. Сонымен, қан плазмасындағы ең маңызды ақуыз болып табылатын альбумин белсенді орталыққа май қышқылдары, билирубин, кейбір дәрілік заттар және т.б. сияқты гидрофобты лигандтарды қосу арқылы өзінің тасымалдау қызметін көрсетеді (1.14-сурет).
Пептидтік тізбектің үш өлшемді құрылымымен әрекеттесетін лигандтар төмен молекулалық салмақты органикалық және бейорганикалық молекулалар ғана емес, сонымен қатар макромолекулалар болуы мүмкін:
ДНҚ (жоғарыда ДНҚ байланыстыратын ақуыздармен қарастырылған мысалдар);
полисахаридтер;
 Күріш. 1.14. Генотип пен фенотиптің байланысы
Күріш. 1.14. Генотип пен фенотиптің байланысы
ДНҚ молекуласында кодталған адам белоктарының бірегей бастапқы құрылымы жасушаларда бірегей конформация, белсенді сайт құрылымы және ақуыз функциялары түрінде жүзеге асырылады.
Бұл жағдайларда белок лигандтың байланыстыру орнына сәйкес келетін және оны толықтыратын белгілі бір аймағын таниды. Сонымен, гепатоциттердің бетінде инсулин гормонының рецепторлық белоктары бар, оларда да бар белок құрылымы. Инсулиннің рецептормен әрекеттесуі оның конформациясының өзгеруін және сигналдық жүйелердің белсендірілуін тудырады, тамақтанғаннан кейін гепатоциттерде қоректік заттардың жиналуына әкеледі.
Осылайша, Белоктардың қызметі белоктың белсенді орталығының лигандпен ерекше әрекеттесуіне негізделген.
2. Домен құрылымы және оның белоктардың қызметіндегі рөлі.Глобулярлы белоктардың ұзын полипептидтік тізбектері жиі бірнеше ықшам, салыстырмалы түрде тәуелсіз аймақтарға бүктеледі. Олар глобулярлы белоктарға ұқсайтын тәуелсіз үшінші реттік құрылымға ие және деп аталады домендер.Белоктардың домендік құрылымына байланысты олардың үшінші реттік құрылымын қалыптастыру оңайырақ.
Домен белоктарында лигандтарды байланыстыратын тораптар көбінесе домендер арасында орналасады. Сонымен, трипсин - бұл ұйқы безінің экзокринді бөлігі шығаратын және тағамдық ақуыздарды қорытуға қажет протеолитикалық фермент. Ол екі доменді құрылымға ие және трипсиннің лигандымен - тағамдық ақуызбен байланысу орны екі домен арасындағы ойықта орналасқан. Белсенді орталықта тағамдық ақуыздың белгілі бір учаскесінің тиімді байланысуы және оның пептидтік байланыстарының гидролизі үшін қажетті жағдайлар жасалады.
Белсенді орталық лигандпен әрекеттескенде ақуыздағы әртүрлі домендер бір-біріне қатысты қозғала алады (1.15-сурет).
Гексокиназа- АТФ көмегімен глюкозаның фосфорлануын катализдейтін фермент. Ферменттің белсенді аймағы екі домен арасындағы саңылауда орналасқан. Гексокиназа глюкозамен байланысқан кезде қоршаған домендер жабылады және субстрат ұсталады, онда фосфорлану жүреді (1.15-суретті қараңыз).
 Күріш. 1.15. Гексокиназа домендерінің глюкозамен байланысуы
Күріш. 1.15. Гексокиназа домендерінің глюкозамен байланысуы
Кейбір белоктарда домендер әртүрлі лигандтармен байланысу арқылы тәуелсіз функцияларды орындайды. Мұндай белоктар көп функциялы деп аталады.
3. Дәрілік заттар – белоктардың қызметіне әсер ететін лигандтар.Белоктардың лигандтармен әрекеттесуі ерекше. Дегенмен, ақуыздың конформациялық лабильділігіне және оның белсенді аймағына байланысты, белсенді аймақтағы немесе молекуланың басқа бөлігіндегі ақуызмен де әрекеттесе алатын басқа затты таңдауға болады.
Құрылымы бойынша табиғи лигандқа ұқсас зат деп аталады лигандтың құрылымдық аналогынемесе табиғи емес лиганд. Ол сондай-ақ белсенді аймақтағы ақуызмен әрекеттеседі. Лигандтың құрылымдық аналогы белок қызметін күшейте алады (агонист)және оны азайтыңыз (антагонист).Лиганд және оның құрылымдық аналогтары бір жерде белокпен байланысу үшін бір-бірімен бәсекелеседі. Мұндай заттар деп аталады бәсекеге қабілетті модуляторларбелок функцияларының (регуляторлары). Көптеген препараттар ақуыз ингибиторлары ретінде әрекет етеді. Олардың кейбіреулері табиғи лигандтардың химиялық модификациясы арқылы алынады. Протеин функциясының ингибиторлары есірткі және улану болуы мүмкін.
Атропин М-холинергиялық рецепторлардың бәсекеге қабілетті тежегіші болып табылады.Ацетилхолин - трансмиссиялық нейротрансмиттер жүйке импульсіхолинергиялық синапстар арқылы. Қозуды жүргізу үшін синапстық саңылауға бөлінген ацетилхолин постсинапстық мембрананың рецепторы - ақуызбен әрекеттесуі керек. Екі түрі табылды холинергиялық рецепторлар:
М-рецепторацетилхолиннен басқа мускаринмен (шыбынның уыты) селективті әрекеттеседі. М - холинергиялық рецепторлар тегіс бұлшықеттерде болады және ацетилхолинмен әрекеттескенде олардың жиырылуын тудырады;
Н-рецепторникотинмен арнайы байланысады. N-холинергиялық рецепторлар жолақты қаңқа бұлшықеттерінің синапстарында кездеседі.
арнайы ингибитор М-холинергиялық рецепторларатропин болып табылады. Ол белладонна және тауық тұқымдас өсімдіктерде кездеседі.
 Атропиннің құрылымында ацетилхолинге ұқсас функционалды топтары және олардың кеңістіктік орналасуы бар, сондықтан ол М-холинергиялық рецепторлардың бәсекелес тежегіштеріне жатады. Ацетилхолиннің М-холинергиялық рецепторлармен байланысуы тегіс бұлшықеттердің жиырылуын тудыратынын ескере отырып, атропин олардың спазмын жеңілдететін дәрі ретінде қолданылады. (спазмодикалық).Осылайша, көз түбін қарау кезінде көздің бұлшық еттерін босаңсу үшін, сондай-ақ асқазан-ішек коликіндегі спазмды жеңілдету үшін атропинді қолдану белгілі. Орталықта М-холинергиялық рецепторлар да бар жүйке жүйесі(ОЖЖ), сондықтан атропиннің үлкен дозалары орталық жүйке жүйесінен жағымсыз реакция тудыруы мүмкін: қозғалтқыш және психикалық қозу, галлюцинация, конвульсия.
Атропиннің құрылымында ацетилхолинге ұқсас функционалды топтары және олардың кеңістіктік орналасуы бар, сондықтан ол М-холинергиялық рецепторлардың бәсекелес тежегіштеріне жатады. Ацетилхолиннің М-холинергиялық рецепторлармен байланысуы тегіс бұлшықеттердің жиырылуын тудыратынын ескере отырып, атропин олардың спазмын жеңілдететін дәрі ретінде қолданылады. (спазмодикалық).Осылайша, көз түбін қарау кезінде көздің бұлшық еттерін босаңсу үшін, сондай-ақ асқазан-ішек коликіндегі спазмды жеңілдету үшін атропинді қолдану белгілі. Орталықта М-холинергиялық рецепторлар да бар жүйке жүйесі(ОЖЖ), сондықтан атропиннің үлкен дозалары орталық жүйке жүйесінен жағымсыз реакция тудыруы мүмкін: қозғалтқыш және психикалық қозу, галлюцинация, конвульсия.
Дитилин жүйке-бұлшықет синапстарының қызметін тежейтін Н-холинергиялық рецепторлардың бәсекеге қабілетті агонисі болып табылады.
 Қаңқа бұлшықеттерінің жүйке-бұлшықет синапстарында Н-холинергиялық рецепторлар болады. Олардың ацетилхолинмен әрекеттесуі бұлшықеттердің жиырылуына әкеледі. Кейбір хирургиялық операцияларда, сондай-ақ эндоскопиялық зерттеулерде қаңқа бұлшықеттерінің босаңсуын тудыратын препараттар қолданылады. (бұлшық ет босаңсытқыштары).Оларға ацетилхолиннің құрылымдық аналогы болып табылатын дитилин жатады. Ол Н-холинергиялық рецепторларға қосылады, бірақ ацетилхолинге қарағанда ол ацетилхолинэстераза ферментінің әсерінен өте баяу жойылады. Иондық арналардың ұзақ ашылуы және мембрананың тұрақты деполяризациясы нәтижесінде жүйке импульсінің өткізгіштігі бұзылып, бұлшықет релаксациясы пайда болады. Бастапқыда бұл қасиеттер кураре уында табылды, сондықтан мұндай препараттар деп аталады курариформа.
Қаңқа бұлшықеттерінің жүйке-бұлшықет синапстарында Н-холинергиялық рецепторлар болады. Олардың ацетилхолинмен әрекеттесуі бұлшықеттердің жиырылуына әкеледі. Кейбір хирургиялық операцияларда, сондай-ақ эндоскопиялық зерттеулерде қаңқа бұлшықеттерінің босаңсуын тудыратын препараттар қолданылады. (бұлшық ет босаңсытқыштары).Оларға ацетилхолиннің құрылымдық аналогы болып табылатын дитилин жатады. Ол Н-холинергиялық рецепторларға қосылады, бірақ ацетилхолинге қарағанда ол ацетилхолинэстераза ферментінің әсерінен өте баяу жойылады. Иондық арналардың ұзақ ашылуы және мембрананың тұрақты деполяризациясы нәтижесінде жүйке импульсінің өткізгіштігі бұзылып, бұлшықет релаксациясы пайда болады. Бастапқыда бұл қасиеттер кураре уында табылды, сондықтан мұндай препараттар деп аталады курариформа.
ТАҚЫРЫП 1.3. НЕГІЗДІҢ ДЕНАТУРАЦИЯСЫ ЖӘНЕ ОНЫҢ СОНТАНДЫ ЖАҢА ҚАЛУ МҮМКІНДІГІ
1. Белоктардың табиғи конформациясы әлсіз өзара әрекеттесу, ақуызды қоршап тұрған ортаның құрамы мен қасиеттерінің өзгеруі, химиялық реагенттердің әсері және физикалық факторларолардың конформациясының өзгеруін тудырады (конформациялық лабильдік қасиеті). Көптеген байланыстардың үзілуі нативті конформацияның бұзылуына және ақуыздың денатурациясына әкеледі.
Ақуыздың денатурациясы- бұл белоктың кеңістіктік құрылымын тұрақтандыратын әлсіз байланыстардың үзілуінен туындаған денатурациялаушы агенттердің әсерінен олардың табиғи конформациясының бұзылуы. Денатурация белоктың бірегей үш өлшемді құрылымы мен белсенді орталығының бұзылуымен және оның биологиялық белсенділігінің жоғалуымен бірге жүреді (1.16-сурет).
Бір ақуыздың барлық денатуратталған молекулалары бір белоктың басқа молекулаларынан ерекшеленетін кездейсоқ конформацияға ие болады. Белсенді орталықты құрайтын аминқышқылдарының радикалдары кеңістікте бір-бірінен алшақ болып шығады, яғни. ақуыздың лигандпен арнайы байланысу орны бұзылады. Денатурация кезінде белоктардың бастапқы құрылымы өзгеріссіз қалады.
Биологиялық зерттеулерде және медицинада денатурациялаушы агенттерді қолдану.Биохимиялық зерттеулерде биологиялық материалдағы төмен молекулалық қосылыстарды анықтау алдында әдетте ерітіндіден ақуыздар алынады. Осы мақсатта көбінесе үшхлорсірке қышқылы (TCA) қолданылады. Ерітіндіге TCA қосқаннан кейін денатуратталған ақуыздар тұнбаға түседі және сүзу арқылы оңай жойылады (1.1-кесте).
Медицинада денатурациялаушы заттар көбінесе медициналық аспаптар мен материалдарды автоклавтарда зарарсыздандыру үшін (денатурациялаушы агент - жоғары температура) және антисептиктер ретінде (спирт, фенол, хлорамин) патогенді микрофлорасы бар ластанған беттерді өңдеу үшін қолданылады.
2. Белоктың өздігінен регенерациялануы- белоктардың біріншілік құрылымының, конформациясының және қызметінің детерминизмін дәлелдеу. Жеке белоктар - бұл бір геннің өнімдері, олардың аминқышқылдарының тізбегі бірдей және жасушада бірдей конформацияға ие болады. Белоктың бастапқы құрылымында оның конформациясы мен қызметі туралы ақпарат бар деген іргелі қорытынды кейбір белоктардың (атап айтқанда, рибонуклеаза мен миоглобиннің) өздігінен ренатациялану – денатурациядан кейін өзінің табиғи конформациясын қалпына келтіру қабілеті негізінде жасалды.
Ақуыздың кеңістіктік құрылымдарының қалыптасуы өздігінен құрастыру әдісімен жүзеге асады – бірегей бастапқы құрылымы бар полипептидтік тізбек ерітіндіде ең кіші конформацияны қабылдауға бейім болатын өздігінен жүретін процесс. бос энергия. Денатурациядан кейін бастапқы құрылымын сақтайтын белоктарды регенерациялау қабілеті рибонуклеаза ферментімен жүргізілген тәжірибеде сипатталған.
Рибонуклеаза – РНҚ молекуласындағы жеке нуклеотидтер арасындағы байланысты үзетін фермент. Бұл глобулярлы ақуыздың бір полипептидтік тізбегі бар, оның үшінші реттік құрылымы көптеген әлсіз және төрт дисульфидті байланыстармен тұрақтанған.
Рибонуклеазаны молекуладағы сутектік байланыстарды бұзатын мочевинамен және дисульфидті байланыстарды үзетін тотықсыздандырғышпен өңдеу ферменттің денатурациясына және оның белсенділігінің жоғалуына әкеледі.
Денатурациялаушы агенттерді диализ арқылы жою ақуыздың конформациясы мен функциясын қалпына келтіруге әкеледі, т.б. реанимацияға. (1.17-сурет).
 Күріш. 1.17. Рибонуклеазаның денатурациясы және ренатациялануы
Күріш. 1.17. Рибонуклеазаның денатурациясы және ренатациялануы
А – рибонуклеазаның нативті конформациясы, оның үшінші реттік құрылымында төрт дисульфидтік байланыс бар; В – денатуратталған рибонуклеаза молекуласы;
В – құрылымы мен қызметі қалпына келтірілген ренативтік рибонуклеаза молекуласы
1. 1.2 кестені толтырыңыз.
1.2-кесте. Радикалдардың полярлығына қарай аминқышқылдарының жіктелуі
2. Тетрапептидтің формуласын жаз:
Asp - Pro - Fen - Liz
а) пептидтік магистральді құрайтын пептидтегі қайталанатын топтарды және аминқышқылдарының радикалдарымен ұсынылған айнымалы топтарды бөліп алу;
b) N- және C-терминалдарын белгілеңіз;
в) пептидтік байланыстың астын сызу;
г) бірдей аминқышқылдарынан тұратын басқа пептидті жаз;
д) аминқышқылдарының құрамы ұқсас ықтимал тетрапептидтік нұсқалардың санын санау.
3. Сүтқоректілердің нейрогипофизінің құрылымы жағынан ұқсас және эволюциялық жақын екі пептидті гормоны – окситоцин мен вазопрессинді салыстырмалы талдау мысалында белоктардың біріншілік құрылымының рөлін түсіндіріңіз (1.3-кесте).
1.3-кесте. Окситоцин мен вазопрессиннің құрылысы мен қызметі
 Осыған:
Осыған:
а) екі пептидтің құрамы мен аминқышқылдарының ретін салыстыру;
б) екі пептидтің біріншілік құрылысының ұқсастығын және олардың биологиялық әрекетінің ұқсастығын табу;
в) екі пептидтің құрылысындағы айырмашылықты және олардың қызметтеріндегі айырмашылықты табу;
г) пептидтердің біріншілік құрылымының олардың қызметіне әсері туралы қорытынды жасау.
4. Глобулярлы белоктардың конформациясының қалыптасуының негізгі кезеңдерін сипаттаңыз (екінші, үшінші реттік құрылымдар, суперекіншілік құрылым туралы түсінік). Белок құрылымдарының түзілуіне қатысатын байланыс түрлерін көрсетіңіз. Қандай аминқышқылдарының радикалдары гидрофобты әрекеттесулердің, иондық, сутектік байланыстардың түзілуіне қатыса алады.
Мысалдар келтіріңіз.
5. «Белоктардың конформациялық лабильділігі» ұғымына анықтама беріңіз, оның пайда болу себептері мен маңызын көрсетіңіз.
6. Келесі сөз тіркесінің мағынасын түсіндіріңіз: «Белоктар лигандпен ерекше әрекеттесу негізінде қызмет етеді», терминдерді қолданып, олардың мағынасын түсіндіріңіз: ақуыз конформациясы, белсенді орын, лиганд, комплементарлық, ақуыз қызметі.
7. Мысалдардың бірін пайдаланып, домендердің не екенін және олардың белоктардың қызметіндегі рөлі қандай екенін түсіндіріңіз.
ӨЗІН-ӨЗІ БАҚЫЛАУ Тапсырмалары
1. Сәйкестік орнату.
Амин қышқылы радикалындағы функционалдық топ:
A. Карбоксил тобы B. Гидроксил тобы C. Гуанидин тобы D. Тиол тобы E. Аминотобы
2. Дұрыс жауаптарды таңдаңыз.
Полярлы зарядсыз радикалдары бар аминқышқылдары:
A. Tsis B. Asn
B. Glu G. Үш
3. Дұрыс жауаптарды таңдаңыз.
Амин қышқылының радикалдары:
A. Бастапқы құрылымның ерекшелігін қамтамасыз ету B. Үшіншілік құрылымның қалыптасуына қатысу
B. Ақуыздың бетінде орналасқандықтан, оның ерігіштігіне әсер етеді D. Белсенді орталық құрайды
D. Пептидтік байланыстың түзілуіне қатысу
4. Дұрыс жауаптарды таңдаңыз.
Аминқышқылдарының радикалдары арасында гидрофобты әрекеттесулер пайда болуы мүмкін:
A. Tre Lay B. Pro Three
B. Met Ile G. Tir Ala D. Val Fen
5. Дұрыс жауаптарды таңдаңыз.
Аминқышқылдарының радикалдары арасында иондық байланыс түзілуі мүмкін:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Goese Asp D. Asn Сәуір
6. Дұрыс жауаптарды таңдаңыз.
Аминқышқылдарының радикалдары арасында сутектік байланыс түзілуі мүмкін:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Сәйкестік орнату.
Белок құрылымының түзілуіне қатысатын байланыс түрі:
A. Бастапқы құрылым B. Қосалқы құрылым
B. Үшіншілік құрылым
D. Жоғары екіншілік құрылым E. Конформация.
1. Пептидтік магистраль атомдары арасындағы сутектік байланыс
2. Амин қышқылы радикалдарының функционалдық топтары арасындағы әлсіз байланыстар
3. Амин қышқылдарының α-амин және α-карбоксил топтары арасындағы байланыс
8. Дұрыс жауаптарды таңдаңыз. Трипсин:
A. Протеолитикалық фермент B. Құрамында екі домен бар
B. Крахмалды гидролиздейді
D. Белсенді орталық домендер арасында орналасқан. D. Екі полипептидтік тізбектен тұрады.
9. Дұрыс жауаптарды таңдаңыз. Атропин:
A. Нейротрансмиттер
B. Ацетилхолиннің құрылымдық аналогы
B. Н-холинергиялық рецепторлармен әрекеттеседі
G. Холинергиялық синапс арқылы жүйке импульсінің өткізілуін күшейтеді
D. М-холинергиялық рецепторлардың бәсекелес ингибиторы
10. Дұрыс мәлімдемелерді таңдаңыз. Ақуыздарда:
A. Бастапқы құрылым өзінің белсенді сайтының құрылымы туралы ақпаратты қамтиды
B. Белсенді орталық бастапқы құрылым деңгейінде қалыптасады
B. Конформация коваленттік байланыстармен қатаң бекітілген
D. Белсенді учаске ұқсас лигандтар тобымен әрекеттесе алады
белоктардың конформациялық лабильділігіне байланысты D. Өзгеруі қоршаған орта, белсендінің жақындығына әсер етуі мүмкін
орталықтан лигандқа
1. 1-C, 2-D, 3-B.
3. A, B, C, D.
7. 1-В, 2-Д, 3-А.
8. A, B, C, D.
НЕГІЗГІ ТЕРМИНДЕР МЕН ТҮСІНІКТЕР
1. Белок, полипептид, амин қышқылдары
2. Біріншілік, екіншілік, үшіншілік белок құрылымдары
3. Конформация, нативті белок конформациясы
4. Белоктағы коваленттік және әлсіз байланыстар
5. Конформациялық лабильділік
6. Белсенді протеин
7. Лигандалар
8. Белоктардың қатпарлануы
9. Лигандтардың құрылымдық аналогтары
10. Домен белоктары
11. Қарапайым және күрделі белоктар
12. Ақуызды денатурациялау, денатурациялаушы заттар
13. Ақуыз регенерациясы
Мәселелерді шешу
«Белоктардың құрылымдық ұйымдастырылуы және олардың қызмет ету негіздері»
1. Белоктың негізгі қызметі – гемоглобин А (HbA) – оттегін ұлпаларға тасымалдау. адам популяциясына белгілі көпше түрлеріБұл ақуыздың қасиеттері мен қызметі өзгерген – анормальды гемоглобиндер деп аталады. Мысалы, орақ жасушалы анемия (HbS) бар науқастардың эритроциттерінен табылған гемоглобин S оттегінің парциалды қысымы төмен болған жағдайда (веноздық қанда болатындай) ерігіштігі төмен екендігі анықталды. Бұл осы ақуыздың агрегаттарының пайда болуына әкеледі. Ақуыз өз қызметін жоғалтады, тұнбаға түседі, эритроциттер жиналады дұрыс емес пішін(олардың кейбіреулері орақ пішінді құрайды) және көкбауырда әдеттегіден тезірек жойылады. Нәтижесінде орақ жасушалы анемия дамиды.
HvA-ның бастапқы құрылымындағы жалғыз айырмашылық гемоглобиннің β-тізбегінің N-терминал аймағында табылды. β-тізбектің N-соңғы аймақтарын салыстырыңыз және белоктың біріншілік құрылымындағы өзгерістер оның қасиеттері мен қызметіне қалай әсер ететінін көрсетіңіз.
 Осыған:
Осыған:
а) HvA қандай аминқышқылдарының формулаларын жазыңыз және осы аминқышқылдарының қасиеттерін салыстырыңыз (полярлық, заряд).
б) ұлпада ерігіштіктің төмендеуі және оттегінің тасымалдануының бұзылуының себебі туралы қорытынды жасау.
2. Суретте лигандтарды байланыстыру орталығы (активті орталық) бар ақуыздың құрылымының диаграммасы көрсетілген. Лиганды таңдауда белок неліктен селективті болатынын түсіндіріңіз. Осыған:
а) белоктың активті орталығы қандай екенін есте сақтаңыз және суретте көрсетілген белоктың белсенді орталығының құрылымын қарастырыңыз;
б) белсенді орталықты құрайтын аминқышқылдарының радикалдарының формулаларын жазу;
в) ақуыздың белсенді аймағымен арнайы әрекеттесе алатын лигандты сызыңыз. Онда белсенді орталықты құрайтын аминқышқылдарының радикалдарымен байланыс түзуге қабілетті функционалдық топтарын көрсетіңіз;
г) активті орталықтың лиганд пен аминқышқылдарының радикалдары арасында пайда болатын байланыс түрлерін көрсетіңіз;
д) Белоктың лигандпен әрекеттесу ерекшелігінің негізін түсіндіріңіз.
 3.
Суретте ақуыздың және бірнеше лигандтардың белсенді орны көрсетілген.
3.
Суретте ақуыздың және бірнеше лигандтардың белсенді орны көрсетілген.
Лигандтардың қайсысы белоктың белсенді жерімен әрекеттесуі мүмкін екенін және неліктен екенін анықтаңыз.
 Белок-лиганд кешенінің түзілуі кезінде қандай байланыс түрлері пайда болады?
Белок-лиганд кешенінің түзілуі кезінде қандай байланыс түрлері пайда болады?
4. Табиғи ақуыз лигандтарының құрылымдық аналогтары белоктардың белсенділігін өзгерту үшін дәрілік заттар ретінде қолданылуы мүмкін.
Ацетилхолин жүйке-бұлшықет синапстарында қозуды тасымалдау медиаторы болып табылады. Ацетилхолин белоктармен – қаңқа бұлшықеттерінің постсинаптикалық мембранасының рецепторларымен әрекеттескенде иондық арналар ашылып, бұлшықеттің жиырылуы пайда болады. Дитилин - бұлшық еттерді босаңсу үшін кейбір операцияларда қолданылатын дәрі, өйткені ол жүйке импульстарының жүйке-бұлшықет синапстары арқылы берілуін бұзады. Дитилиннің бұлшықет босаңсытқышы ретінде әсер ету механизмін түсіндіріңіз. Осыған:
а) ацетилхолин мен дитилиннің формулаларын жазып, құрылысын салыстыру;
б) дитилиннің босаңсыту әсерінің механизмін сипаттаңыз.
5. Кейбір ауруларда науқастың дене температурасы көтеріледі, бұл дененің қорғаныс реакциясы ретінде қарастырылады. Дегенмен, жоғары температура дененің ақуыздарына зиян келтіреді. Неліктен 40 °C жоғары температурада белоктардың қызметі бұзылып, адам өміріне қауіп төнетінін түсіндіріңіз. Мұны істеу үшін есте сақтаңыз:
1) Белоктардың құрылымы және оның құрылымын нативті конформацияда ұстайтын байланыстар;
2) Температура жоғарылағанда белоктардың құрылысы мен қызметі қалай өзгереді?;
3) Гомеостаз дегеніміз не және адам денсаулығын сақтау неліктен маңызды.
Модульдік блок 2 РЕГАТОРЛЫҚ ӘСЕР ҮШІН МАҚСАТТАР РЕТІНДЕ ОЛИГОМЕРЛІК БЕЛГІЛЕР. БЕЛГІЛЕРДІҢ ҚҰРЫЛЫМДЫҚ ЖӘНЕ ФУНКЦИЯЛЫҚ ТҮРЛІЛІГІ. БЕЛГІЛЕРДІ БӨЛУ ЖӘНЕ ТАЗАЛАУ ӘДІСТЕРІ
Оқу мақсаттары Істей білу:
1.Олигомерлі белоктардың құрылысы мен қызметтерінің ерекшеліктері туралы білімдерін олардың қызметтерін реттеудің адаптивті механизмдерін түсіну үшін пайдалану.
2. Шаперондардың жасушадағы ақуыз конформациясының синтезі мен сақталуындағы рөлін түсіндіріңіз.
3. Организмде синтезделетін белоктардың құрылымдары мен қызметтерінің алуан түрлілігі арқылы тіршілік көріністерінің көптүрлілігін түсіндіру.
4. Туысқан гемопротеидтерді – миоглобин мен гемоглобинді, сондай-ақ иммуноглобулиндердің бес класы белоктарының өкілдерін салыстыра отырып, белоктардың құрылысы мен олардың қызметі арасындағы байланысты талдаңыз.
5. Белоктардың физика-химиялық қасиеттерінің ерекшеліктері туралы білімдерін оларды басқа белоктар мен қоспалардан тазарту әдістерін таңдау үшін қолдану.
6. Клиникалық диагнозды растау немесе нақтылау үшін қан плазмасының ақуыздарының сандық және сапалық құрамының нәтижелерін интерпретациялау.
Білу:
1. Гемоглобин мысалында олигомерлі белоктардың құрылыс ерекшеліктері және олардың қызметтерін реттеудің адаптивті механизмдері.
2. Шаперондардың құрылысы мен қызметтері және олардың жасушадағы белоктардың табиғи конформациясын сақтаудағы маңызы.
3. Иммуноглобулиндер мысалында белоктарды конформациясы мен қызметтерінің ұқсастығына қарай тұқымдастарға топтастыру принциптері.
4. Белоктарды олардың физика-химиялық қасиеттерінің ерекшеліктеріне қарай бөлу әдістері.
5. Қан плазмасының электрофорезі белоктардың сапалық және сандық құрамын бағалау әдісі ретінде.
ТАҚЫРЫП 1.4. ГЕМОГЛОБИН МЫСАЛЫНДА ОЛИГОМЕРЛІК НЕГІЗДЕРДІҢ ҚҰРЫЛЫСЫ МЕН ҚЫЗМЕТІНІҢ ЕРЕКШЕЛІКТЕРІ
1. Көптеген ақуыздарда бірнеше полипептидтік тізбектер бар. Мұндай белоктар деп аталады олигомерлік,және жеке тізбектер протомерлер.Олигомерлі белоктардағы протомерлер көптеген әлсіз ковалентті емес байланыстармен (гидрофобты, иондық, сутегі) байланысады. Өзара әрекеттесу
протомерлердің арқасында жүзеге асырылады толықтыруолардың жанасу беттері.
Олигомерлі белоктардағы протомерлердің саны әр түрлі болуы мүмкін: гемоглобиннің құрамында 4 протомер, аспартатаминотрансфераза ферментінде - 12 протомер, ал темекі мозаикалық вирусының ақуызында ковалентті емес байланыстар арқылы байланысқан 2120 протомер бар. Сондықтан олигомерлі белоктар өте жоғары молекулалық салмаққа ие болуы мүмкін.
Бір протомердің басқалармен әрекеттесуін белоктың лигандпен әрекеттесуінің ерекше жағдайы ретінде қарастыруға болады, өйткені әрбір протомер басқа протомерлер үшін лиганд қызметін атқарады. Белоктағы протомерлердің саны мен қосылу әдісі деп аталады төрттік белок құрылымы.
Белоктардың құрамында бірдей немесе әртүрлі құрылымның протомерлері болуы мүмкін, мысалы, гомодимерлер – екі бірдей протомерлері бар белоктар, ал гетеродимерлер – екі түрлі протомерлері бар белоктар.
Егер белоктарда әртүрлі протомерлер болса, онда оларда құрылымы жағынан әр түрлі лигандтары бар байланыстыру орталықтары пайда болуы мүмкін. Лиганд белсенді орталықпен байланысқанда бұл ақуыздың қызметі көрінеді. Басқа протомерде орналасқан орталық аллостериялық (белсендіден басқа) деп аталады. Байланыс аллостериялық лиганд немесе эффектор,ол реттеуші функцияны орындайды (1.18-сурет). Аллостериялық орталықтың эффектормен әрекеттесуі конформациялық лабильділігіне байланысты бүкіл олигомерлі белоктың құрылымында конформациялық өзгерістерді тудырады. Бұл белсенді аймақтың белгілі бір лигандқа жақындығына әсер етеді және осы ақуыздың қызметін реттейді. Олигомерлі белоктың кем дегенде бір лигандпен әрекеттесуі кезінде барлық протомерлердің конформациясы мен қызметінің өзгеруін кооперативтік конформация өзгерісі деп атайды. Белок қызметін күшейтетін эффекторлар деп аталады активаторларжәне оның қызметін төмендететін эффекторлар - ингибиторлар.
Сонымен, олигомерлі белоктарда, сондай-ақ домендік құрылымы бар белоктарда мономерлі белоктармен салыстырғанда жаңа қасиет пайда болады – функцияларды аллостериялық реттеу қабілеті (ақуызға әртүрлі лигандтарды қосу арқылы реттеу). Мұны миоглобин мен гемоглобиннің бір-бірімен тығыз байланысты екі күрделі белоктардың құрылымдары мен қызметтерін салыстыру арқылы көруге болады.
 Күріш. 1.18. Димерлі белоктың құрылымының диаграммасы
Күріш. 1.18. Димерлі белоктың құрылымының диаграммасы
2. Кеңістіктік құрылымдардың қалыптасуы және миоглобиннің қызметі.
Миоглобин (Мб) - қызыл бұлшықеттерде кездесетін ақуыз, оның негізгі қызметі бұлшықеттердің қарқынды жұмысына қажетті O 2 қорын жасау болып табылады. МБ – құрамында белок бөлігі – apoMB және белоксыз бөлігі – гем бар күрделі ақуыз. apoMB-ның біріншілік құрылымы оның ықшам глобулярлық конформациясын және миоглобиннің белоксыз бөлігі гем бекітілген белсенді орталықтың құрылымын анықтайды. Қаннан бұлшық еттерге оттегі миоглобиннің құрамындағы Fe+2 гемімен байланысады. МБ – мономерлік ақуыз, O 2-ге өте жоғары жақындығы бар, сондықтан миоглобинмен оттегі тек қарқынды бұлшықет жұмысы кезінде, О 2 парциалды қысымы күрт төмендегенде бөлінеді.
МБ конформациясының қалыптасуы.Қызыл бұлшықеттерде, рибосомаларда трансляция кезінде 153 амин қышқылы қалдықтарының белгілі бір тізбегімен ұсынылған МБ-ның бастапқы құрылымының синтезі жүреді. Mv-нің екінші реттік құрылымы А-дан Н-ге дейінгі латын әріптері деп аталатын сегіз α-спиральдан тұрады, олардың арасында спиральданбаған бөлімдер бар. Mv-тің үшінші реттік құрылымы ықшам шар тәрізді пішінге ие, оның ойығында F және E α-спиральдар арасында белсенді орталық орналасқан (1.19-сурет).
 Күріш. 1.19. Миоглобиннің құрылысы
Күріш. 1.19. Миоглобиннің құрылысы
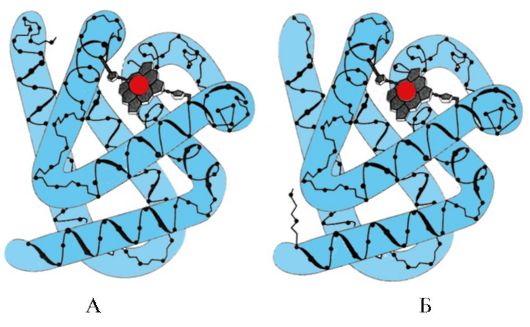
3. МВ белсенді орталығының құрылымы мен қызмет ету ерекшеліктері. Mv активті орталығы негізінен біріншілік құрылымы бойынша бір-бірінен алшақ орналасқан гидрофобты аминқышқылдарының радикалдарынан түзіледі (мысалы, Tri 3 9 және Phen 138) Суда нашар еритін лигандтар, гем және O 2, белсенді орталыққа бекітілген. Гем – спецификалық apoMv лиганд (1.20-сурет), оның негізінде метенил көпірлері арқылы қосылған төрт пиррол сақиналары жатыр; ортасында төрт координациялық байланыс арқылы пиррол сақиналарының азот атомдарымен байланысқан Fe+ 2 атомы бар. Мв белсенді орталығында аминқышқылдарының гидрофобты радикалдарынан басқа гидрофильді радикалдары бар екі аминқышқылының қалдықтары да бар - Gis E 7(Gis 64) және Gis F 8(Оның 93) (1.21-сурет).
 Күріш. 1.20. Гемнің құрылымы – миоглобин мен гемоглобиннің белоксыз бөлігі
Күріш. 1.20. Гемнің құрылымы – миоглобин мен гемоглобиннің белоксыз бөлігі
 Күріш. 1.21. Апомиоглобин мен гемоглобин протомерлерінің белсенді аймағында гем мен О 2 орналасуы
Күріш. 1.21. Апомиоглобин мен гемоглобин протомерлерінің белсенді аймағында гем мен О 2 орналасуы
Гем оның F 8-мен темір атомы арқылы ковалентті байланысқан. О 2 гем жазықтығының екінші жағындағы темірге бекітіледі. Оның E 7 O 2 дұрыс бағытталуы үшін қажет және Fe + 2 гемге оттегінің қосылуын жеңілдетеді.
Gis F 8 Fe+ 2-мен координациялық байланыс түзеді және белсенді орталықта гемді берік бекітеді. Gis E 7 Fe+2 геммен әрекеттесу кезінде басқа лиганд – О 2 активті орталығында дұрыс бағытталуы үшін қажет. Гемдік микроорта O 2-нің Fe + 2-мен күшті, бірақ қайтымды байланысуы үшін жағдай жасайды және судың гидрофобты белсенді орталыққа түсуіне жол бермейді, бұл оның Fe + 3 -ке дейін тотығуына әкелуі мүмкін.
МБ мономерлік құрылымы және оның белсенді орталығы ақуыздың O 2-ге жоғары жақындығын анықтайды.
4. Hb-ның олигомерлік құрылымы және лигандтар арқылы O 2-ге Hb сәйкестігінің реттелуі. Адамның гемоглобиндері- белоктар тұқымдасы, сонымен қатар күрделі белоктарға (гемопротеидтерге) жататын миоглобин. Олардың тетрамерлі құрылымы бар және екі α-тізбекті қамтиды, бірақ басқа екі полипептидтік тізбектердің (2α-, 2х-тізбектері) құрылымы бойынша ерекшеленеді. Екінші полипептидтік тізбектің құрылымы Hb осы формаларының қызмет ету ерекшеліктерін анықтайды. Ересек эритроциттердегі гемоглобиннің шамамен 98% құрайды гемоглобин А(2α-, 2p-тізбектері).
Ұрықтың дамуы кезінде гемоглобиндердің екі негізгі түрі бар: эмбриональды HB(2α, 2ε), ол ұрық дамуының ерте кезеңдерінде кездеседі және гемоглобин F (ұрық)- (2α, 2γ), ол ұрық дамуының алтыншы айында ерте ұрықтың гемоглобинін ауыстырады және тек туғаннан кейін Hb A ауыстырылады.
Hv A – ересек эритроциттерде кездесетін миоглобинге (Mv) жататын ақуыз. Оның жеке протомерлерінің құрылымы миоглобиндікіне ұқсас. Миоглобин мен гемоглобин протомерлерінің қайталама және үшінші құрылымдары олардың полипептидтік тізбектерінің біріншілік құрылымында тек 24 аминқышқылдарының қалдықтары бірдей болғанына қарамастан өте ұқсас (гемоглобин протомерлерінің екінші реттік құрылымында, миоглобин сияқты, сегіз α-спираль, А-дан Н-ге дейінгі латын әріптерімен белгіленеді және үшінші құрылым ықшам глобула түрінде болады). Бірақ миоглобиннен айырмашылығы, гемоглобин олигомерлік құрылымға ие, ковалентті емес байланыстармен қосылған төрт полипептидтік тізбектен тұрады (1.22-сурет).
Әрбір Hb протомері белокты емес бөлікпен – геммен және көршілес протомерлермен байланысты. Нв-ның белоктық бөлігінің геммен байланысы миоглобиндікіне ұқсас: белоктың белсенді орталығында гемнің гидрофобты бөліктері His F 8 және His E 7-ден басқа гидрофобты аминқышқылдарының радикалдарымен қоршалған. , олар гем жазықтығының екі жағында орналасқан және ақуыздың қызметінде және оның оттегімен байланысуында ұқсас рөл атқарады (миоглобиннің құрылымын қараңыз).
 Күріш. 1.22. Гемоглобиннің олигомерлік құрылымы
Күріш. 1.22. Гемоглобиннің олигомерлік құрылымы
Сонымен қатар, Gis E 7маңызды орындайды қосымша рөл NV қызметінде. Бос гемнің СО-ға жақындығы O 2-ге қарағанда 25000 есе жоғары. СО организмде аз мөлшерде түзіледі және оның гемге жоғары жақындығын ескере отырып, ол жасуша тіршілігіне қажетті O 2 тасымалдануын бұзуы мүмкін. Алайда гемоглобиннің құрамында гемнің көміртегі тотығына жақындығы His-тің белсенді орталығында Е 7 болуына байланысты O 2-ге жақындығы 200 есе ғана асып түседі. Бұл амин қышқылының қалдығы гемнің О2-мен байланысуына оңтайлы жағдай жасайды және гемнің СО-мен әрекеттесуін әлсіретеді.
5. Hb негізгі қызметі – өкпеден тіндерге O 2 тасымалдау. O 2-ге өте жоғары жақындығы бар және қызыл бұлшықеттерде оттегін сақтау қызметін атқаратын мономерлі миоглобиннен айырмашылығы, гемоглобиннің олигомерлік құрылымы мыналарды қамтамасыз етеді:
1) өкпедегі Hb оттегімен тез қанығуы;
2) Hb салыстырмалы жоғары парциалды қысым O 2 (20-40 мм рт.ст.) кезінде тіндерге оттегін шығару қабілеті;
3) Hb-ның O 2-ге жақындығын реттеу мүмкіндігі.
6. Гемоглобин протомерлерінің конформациясындағы кооперативтік өзгерістер өкпедегі O 2 байланысын және оның тіндерге оралуын тездетеді. Өкпеде O2 жоғары парциалды қысымы оның төрт протомердің (2α және 2β) белсенді орнында Hb-мен байланысуына ықпал етеді. Әрбір протомердің белсенді орталығы, миоглобиндегідей, гидрофобты қалтадағы екі α-спираль (F және E) арасында орналасқан. Оның құрамында белокты емес бөлік – гем бар, белок бөлігіне көптеген әлсіз гидрофобты әрекеттесулер және Fe 2 + гем мен Оның F 8 арасындағы бір күшті байланыс (1.21-суретті қараңыз).
Дезоксигемоглобинде оның F 8-мен осы байланысына байланысты Fe 2 + атомы гем жазықтығынан гистидинге қарай шығып тұрады. O 2-нің Fe 2+-мен байланысуы бір бос координациялық байланыстың көмегімен His E 7 аймағындағы гемнің екінші жағында жүреді. Оның E 7 гемдік темірмен O 2 байланысуы үшін оңтайлы жағдайларды қамтамасыз етеді.
Бір протомердің Fe +2 атомына O 2 қосылуы оның гем жазықтығына, ал оның артында онымен байланысты гистидин қалдығына жылжиды.
 Күріш. 1.23. Гемоглобин протомерінің O 2-мен біріктірілген конформациясының өзгеруі
Күріш. 1.23. Гемоглобин протомерінің O 2-мен біріктірілген конформациясының өзгеруі
Бұл барлық полипептидтік тізбектердің конформациялық лабильділігіне байланысты конформациясының өзгеруіне әкеледі. Басқа тізбектердің конформациясын өзгерту олардың келесі O 2 молекулаларымен әрекеттесуін жеңілдетеді.
Төртінші O 2 молекуласы гемоглобинге біріншіге қарағанда 300 есе оңай қосылады (1.24-сурет).
 Күріш. 1.24. Гемоглобин протомерлерінің О 2-мен әрекеттесуі кезінде конформациясының кооперативтік өзгерістері
Күріш. 1.24. Гемоглобин протомерлерінің О 2-мен әрекеттесуі кезінде конформациясының кооперативтік өзгерістері
Тіндерде әрбір келесі O 2 молекуласы алдыңғысына қарағанда оңай бөлінеді, сонымен қатар протомер конформациясындағы бірлескен өзгерістерге байланысты.
7. Катаболизм кезінде түзілетін СО 2 және Н+ органикалық заттар, гемоглобиннің O 2-ге жақындығын олардың концентрациясына пропорционалды түрде төмендетеді. Жасушаның жұмыс істеуіне қажетті энергия негізінен гемоглобин арқылы өкпеден жеткізілетін O 2 көмегімен органикалық заттардың тотығуы кезінде митохондрияларда өндіріледі. Органикалық заттардың тотығуы нәтижесінде соңғы өнімдеролардың ыдырауы: CO 2 және K 2 O, олардың мөлшері жүріп жатқан тотығу процестерінің қарқындылығына пропорционалды.
СО 2 жасушалардан қанға таралады және эритроциттерге енеді, онда карбангидраза ферментінің әсерінен ол қанға айналады. көмір қышқылы. Бұл әлсіз қышқыл протонға және бикарбонат ионына диссоциацияланады.
H+ GIS радикалдарына қосылуға қабілетті 14 6 гемоглобиннің α- және β-тізбектерінде, яғни. гемнен алыс жерлерде. Гемоглобиннің протондануы оның O 2-ге жақындығын төмендетеді, oxyHb-ден O 2-нің жойылуына, deoxyHb түзілуіне ықпал етеді және түзілген протондар санына пропорционалды түрде тіндердің оттегімен қамтамасыз етілуін арттырады (1.25-сурет).
Эритроциттердегі Н+ концентрациясының артуына байланысты бөлінетін оттегі мөлшерінің артуы Бор эффектісі деп аталады (бұл әсерді алғаш ашқан дат физиологы Кристиан Бордың атымен).
Өкпеде оттегінің жоғары парциалды қысымы оның deoxyHb-мен байланысуына ықпал етеді, бұл ақуыздың H+-ға жақындығын төмендетеді. Карбангидраза әсерінен бөлінген протондар бикарбонаттармен әрекеттесіп, CO 2 және H 2 O түзеді.

 Күріш. 1.25. Hb-ның O 2-ге жақындығының CO 2 және протондар концентрациясына тәуелділігі (Бор эффектісі):
Күріш. 1.25. Hb-ның O 2-ге жақындығының CO 2 және протондар концентрациясына тәуелділігі (Бор эффектісі):
А- СО 2 және Н+ концентрациясының Hb бар кешеннен O 2 бөлінуіне әсері (Бор эффектісі); Б- өкпедегі дезоксигемоглобинді оттегімен қамтамасыз ету, СО 2 түзілуі және бөлінуі.
Алынған СО 2 альвеолярлы кеңістікке еніп, дем шығарылған ауамен бірге шығарылады. Осылайша, тіндерде гемоглобин бөлетін оттегінің мөлшері органикалық заттардың катаболизмі өнімдерімен реттеледі: заттардың ыдырауы неғұрлым қарқынды болса, мысалы, физикалық жүктеме кезінде, СО 2 және H + концентрациясы соғұрлым жоғары болады және соғұрлым көп болады. тіндер оттегіні H-ның O 2-ге жақындығының төмендеуі нәтижесінде алады.
8. Лиганды – 2,3-бисфосфоглицерат арқылы O 2-ге Hb жақындығын аллостериялық реттеу.Эритроциттерде гемоглобиннің аллостериялық лиганды 2,3-бисфосфоглицерат (2,3-БПГ) глюкозаның тотығу өнімінен – 1,3-бифосфоглицераттан синтезделеді. Қалыпты жағдайда 2,3-BPG концентрациясы жоғары және Hb концентрациясымен салыстырмалы. 2,3-BPG күшті теріс заряды -5.
 Тіндік капиллярлардағы бисфосфоглицерат дезоксигемоглобинмен байланысу арқылы тіндердегі оттегінің шығуын арттырады, Hb-ның O 2-ге жақындығын төмендетеді.
Тіндік капиллярлардағы бисфосфоглицерат дезоксигемоглобинмен байланысу арқылы тіндердегі оттегінің шығуын арттырады, Hb-ның O 2-ге жақындығын төмендетеді.
Тетрамерлі гемоглобин молекуласының ортасында қуыс бар. Ол барлық төрт протомердің аминқышқылдарының қалдықтарынан түзіледі (1.22-суретті қараңыз). Тіндік капиллярларда Hb протонациясы (Бор эффектісі) темір гем мен O 2 арасындағы байланысты үзеді. Молекулада
дезоксигемоглобин, оксигемоглобинмен салыстырғанда, протомерлерді байланыстыратын қосымша иондық байланыстар пайда болады, нәтижесінде орталық қуыстың мөлшері оксигемоглобинмен салыстырғанда артады. Орталық қуыс 2,3-БПГ-ның гемоглобинге қосылу орны болып табылады. Орталық қуыстың өлшемдерінің айырмашылығына байланысты 2,3-БПГ тек дезоксигемоглобинге қосыла алады.
2,3-BPG гемоглобинмен ақуыздың белсенді орындарынан қашықтағы аймақта әрекеттеседі және аллостериялық(реттеуші) лигандтар, ал орталық қуысы Hb болып табылады аллостериялық орталық. 2,3-BPG күшті теріс зарядқа ие және екі Hb β-тізбегінің бес оң зарядталған тобымен әрекеттеседі: N-терминал α-амин тобы Val және Lys 82 Gis 143 радикалдары (1.26-сурет).
 Күріш. 1.26. Дезоксигемоглобиннің орталық қуысында BPG
Күріш. 1.26. Дезоксигемоглобиннің орталық қуысында BPG
BPG әрбір β-тізбекте үш оң зарядталған топтармен байланысады.
Ұлпа капиллярларында пайда болған дезоксигемоглобин 2,3-БПГ-мен әрекеттеседі, β-тізбектердің оң зарядты радикалдары мен теріс зарядталған лиганд арасында иондық байланыстар түзіледі, олар белок конформациясын өзгертеді және Hb-ның O 2-ге жақындығын төмендетеді. Hb-ның O 2-ге жақындығының төмендеуі O 2-нің тінге тиімдірек бөлінуіне ықпал етеді.
Өкпеде жоғары парциалды қысымда оттегі Hb-мен әрекеттеседі, темір геміне қосылады; бұл жағдайда белоктың конформациясы өзгереді, орталық қуыс төмендейді, ал 2,3-БПГ аллостериялық орталықтан ығысады.
Осылайша, олигомерлі белоктар мономерлі белоктармен салыстырғанда жаңа қасиеттерге ие. Лигандтардың учаскелерде қосылуы,
бір-бірінен кеңістіктік алыс (аллостериялық), бүкіл ақуыз молекуласында конформациялық өзгерістерді тудыруға қабілетті. Реттеуші лигандтармен әрекеттесуіне байланысты конформация өзгереді және белок молекуласының қызметі қоршаған орта өзгерістеріне бейімделеді.
ТАҚЫРЫП 1.5. ЖАСУША ЖАҒДАЙЫНДАҒЫ БЕЛГІЛІКТЕРДІҢ НАТИВИ КОНФОРМАЦИЯСЫН САҚТАУ
Жасушаларда полипептидтік тізбектердің синтезі кезінде олардың мембраналар арқылы жасушаның сәйкес бөлімдеріне тасымалдануы, қатпарлану процесінде (нативті конформацияның түзілуі) және олигомерлі белоктардың жиналуы кезінде, сонымен қатар олардың жұмыс істеуі кезінде, аралық , белок құрылымында агрегацияға бейім, тұрақсыз конформациялар пайда болады. Әдетте белок молекуласының ішінде табиғи конформациясында жасырылған гидрофобты радикалдар бетінде тұрақсыз конформацияда пайда болады және суда бірдей нашар еритін басқа ақуыздар топтарымен қосылуға бейім. Барлық белгілі организмдердің жасушаларында жасуша белоктарының оңтайлы қатпарлануын қамтамасыз ететін, қызмет ету кезінде олардың нативті конформациясын тұрақтандыратын, ең бастысы гомеостаз бұзылған жағдайда жасушаішілік белоктардың құрылымы мен қызметін сақтайтын арнайы белоктар табылды. Бұл белоктар деп аталады «каперондар»француз тілінен аударғанда «күту» дегенді білдіреді.
1. Молекулярлық шаперондар және олардың ақуыздың денатурациясының алдын алудағы рөлі.
Шаперондар (III) суббірліктердің массасына қарай жіктеледі. Жоғары молекулалық шаперондардың массасы 60-тан 110 кД-ға дейін. Олардың ішінде ең көп зерттелген үш сынып: Ш-60, Ш-70 және Ш-90. Әрбір класқа бір-бірімен байланысты ақуыздар тобы кіреді. Осылайша, Sh-70 құрамында молекулалық салмағы 66-дан 78 кД-ға дейінгі ақуыздар бар. Төмен молекулалық салмақты шаперондардың молекулалық салмағы 40-15 кД болады.
Бақылаушылардың арасында бар құрылтайшыжоғары базальды синтезі дене жасушаларына стресстік әсерге байланысты емес ақуыздар және индукциялық,оның синтезі қалыпты жағдайда әлсіз, бірақ стресстік әсерде күрт артады. Индукцияланатын шаперондарды «жылу соққысының белоктары» деп те атайды, өйткені олар алғаш рет жоғары температураға ұшыраған жасушаларда табылған. Жасушаларда белоктардың жоғары концентрациясына байланысты жартылай денатуратталған белоктардың өздігінен регенерациялануы қиын. Sh-70 басталған денатурация процесін болдырмайды және белоктардың табиғи конформациясын қалпына келтіруге көмектеседі. Молекулярлық шаперондар-70- жасушаның барлық бөліктерінде: цитоплазмада, ядрода, эндоплазмалық ретикулумда, митохондрияда кездесетін жоғары дәрежеде сақталған белоктар класы. Sh-70 жалғыз полипептидтік тізбегінің карбоксил соңында ұзындықтағы пептидтермен әрекеттесе алатын ойық болып табылатын аймақ бар.
Гидрофобты радикалдармен байытылған 7-9 амин қышқылы қалдықтары. Глобулярлы ақуыздардағы мұндай орындар шамамен әрбір 16 аминқышқылында кездеседі. Sh-70 ақуыздарды термиялық инактивациядан қорғауға және ішінара денатуратталған ақуыздардың конформациясы мен белсенділігін қалпына келтіруге қабілетті.
2. Шаперондардың белок қатпарлануындағы рөлі.Рибосомадағы белоктардың синтезі кезінде полипептидтің N-соңғы аймағы С-соңғы аймағынан бұрын синтезделеді. Нәтижелі конформацияны қалыптастыру үшін ақуыздың аминқышқылдарының толық тізбегі қажет. Ақуыз синтезі процесінде шаперондар-70 белсенді орталығының құрылымына байланысты синтез аяқталғанға дейін гидрофобты аминқышқылдарының радикалдарымен байытылған агрегацияға бейім полипептидтік учаскелерді жабуға қабілетті (1.27, А-сурет).
 Күріш. 1.27. Шаперондардың белок қатпарлануына қатысуы
Күріш. 1.27. Шаперондардың белок қатпарлануына қатысуы
А - синтезделген полипептидтің учаскелері арасындағы гидрофобты әрекеттесулердің алдын алуға шаперондар-70 қатысуы; В – шаперон кешенінде белоктың нативті конформациясының қалыптасуы
Домендік құрылым сияқты күрделі конформациясы бар көптеген жоғары молекулалық ақуыздар W-60 түзетін арнайы кеңістікте қатпарланады. Ш-60 14 бөлімшеден тұратын олигомерлі кешен қызметін атқарады. Олар екі қуыс сақина құрайды, олардың әрқайсысы жеті бөлімшеден тұрады, бұл сақиналар бір-бірімен байланысқан. III-60 әрбір суббірлігі үш доменнен тұрады: апикальды (апикальды), сақина қуысына қарайтын гидрофобты радикалдармен байытылған, аралық және экваторлық (1.28-сурет).
 Күріш. 1.28. Шаперонин кешенінің құрылымы 14 Ш-60
Күріш. 1.28. Шаперонин кешенінің құрылымы 14 Ш-60
A - бүйірлік көрініс; B - жоғарғы көрініс
Шаперон сақиналарының қуысына ашылмаған молекулаларға тән беткі элементтері бар синтезделген белоктар, атап айтқанда, гидрофобты радикалдар енеді. Бұл қуыстардың нақты ортасында мүмкін болатын конформацияларды санау жалғыз, энергетикалық жағынан ең қолайлысы табылғанға дейін жүреді (1.27, В-сурет). Конформацияның түзілуі және ақуыздың бөлінуі экваторлық аймақта АТФ гидролизімен жүреді. Әдетте, шаперонға тәуелді мұндай бүктеу энергияның айтарлықтай мөлшерін талап етеді.
Шаперондар белоктардың үш өлшемді құрылымын қалыптастыруға және ішінара денатуратталған белоктарды ренатациялауға қатысудан басқа, олигомерлі белоктардың жиналуы, денатуратталған ақуыздарды лизосомаларға тану және тасымалдау, белоктарды тасымалдау сияқты іргелі процестер үшін де қажет. мембраналар арқылы және ақуыз кешендерінің белсенділігін реттеуге қатысу.
ТАҚЫРЫП 1.6. ПРОТЕИНДІҢ ТҮРЛІ. ИММУНОГЛОБУЛИНДЕР МЫСАЛЫНДАҒЫ БЕЛЕКТІЛІК ОТБАСЫ
1. Белоктар жеке жасушалардың және бүкіл көп жасушалы организмнің өмірінде шешуші рөл атқарады және олардың функциялары таңқаларлық әртүрлі. Бұл белоктардың біріншілік құрылымы мен конформациясының ерекшеліктерімен, белсенді орталықтың ерекше құрылымымен және нақты лигандтарды байланыстыру қабілетімен анықталады.
Пептидтік тізбектердің барлық мүмкін нұсқаларының өте аз ғана бөлігі тұрақты кеңістіктік құрылымды қабылдай алады; көпшілік
олардың шамамен бірдей Гиббс энергиясы бар, бірақ әртүрлі қасиеттері бар көптеген конформацияларды қабылдай алады. Белгілі белоктардың көпшілігінің бастапқы құрылымы, таңдалған биологиялық эволюция, осы ақуыздың жұмыс істеу ерекшеліктерін анықтайтын конформациялардың бірінің ерекше тұрақтылығын қамтамасыз етеді.
2. Белок тұқымдастары.Бір биологиялық түрдің ішінде аминқышқылдарының қалдықтарын алмастыру өзара байланысты функцияларды орындайтын және аминқышқылдарының гомологтық тізбегі бар әртүрлі ақуыздардың пайда болуына әкелуі мүмкін. Мұндай туыстас белоктардың таңғаларлық ұқсас конформациялары бар: α-спиральдардың және/немесе β-құрылымдардың саны мен орналасуы, және полипептидтік тізбектердің бұрылыстары мен қатпарларының көпшілігі ұқсас немесе бірдей. Полипептидтік тізбектің гомологты аймақтары, ұқсас конформациясы және соған байланысты функциялары бар белоктар белоктар тұқымдастарына бөлінеді. Белок тұқымдастарының мысалдары: сериндік протеиназалар, иммуноглобулиндер семьясы, миоглобиндер семьясы.
Сериндік протеиназалар- протеолитикалық ферменттер қызметін атқаратын белоктар семьясы. Оларға ас қорыту ферменттері – химотрипсин, трипсин, эластаза және қанның ұюының көптеген факторлары жатады. Бұл белоктардың 40% бірдей аминқышқылдары және конформациясы өте ұқсас (1.29-сурет).

Күріш. 1.29. Эластазаның (А) және химотрипсиннің (В) кеңістіктік құрылымдары
Кейбір аминқышқылдарының алмастырулары осы белоктардың субстрат ерекшелігінің өзгеруіне және отбасында функционалды әртүрліліктің пайда болуына әкелді.
3. Иммуноглобулиндер тұқымдасы.Иммуноглобулиндердің суперфамилиясының белоктары, оның құрамына үш ақуыз тұқымдасы кіреді, иммундық жүйенің қызметінде үлкен рөл атқарады:
антиденелер (иммуноглобулиндер);
Т-лимфоциттердің рецепторлары;
Негізгі гистосәйкестік кешенінің белоктары – MHC 1 және 2 кластар (Негізгі гистосәйкестік кешені).
Бұл белоктардың барлығы домендік құрылымға ие, гомологтық иммундық тәрізді домендерден тұрады және ұқсас қызметтерді орындайды: олар қанда, лимфада немесе жасушааралық сұйықтықта (антиденелер) еріген бөтен құрылымдармен әрекеттеседі немесе жасушалардың бетінде (меншікті немесе шетелдік).
4. Антиденелер- деп аталатын бөгде құрылымды жұту жауап В-лимфоциттер өндірілген арнайы белоктар антиген.
Антиденелердің құрылысының ерекшеліктері
Қарапайым антидене молекулалары төрт полипептидтік тізбектен тұрады: екі бірдей жеңіл тізбек – L, құрамында шамамен 220 амин қышқылдары және екі бірдей ауыр тізбек – H, 440-700 аминқышқылдарынан тұрады. Антидене молекуласындағы төрт тізбектің барлығы да көптеген ковалентті емес байланыстар және төрт дисульфидтік байланыстар арқылы байланысқан (1.30-сурет).
Антиденелердің жеңіл тізбектері екі доменнен тұрады: айнымалы (VL), полипептидтік тізбектің N-соңғы аймағында орналасқан және тұрақты (CL), С-соңында орналасқан. Ауыр тізбектер әдетте төрт доменге ие: N-терминуста бір айнымалы (VH) және үш тұрақты (CH1, CH2, CH3) (1.30-суретті қараңыз). Әрбір иммуноглобулин доменінде екі цистеин қалдығы дисульфидтік байланыспен байланысқан β-бүрінді қондырма бар.
Екі тұрақты CH1 және CH2 домендерінің арасында екінші реттік құрылымның түзілуіне және осы сегменттегі көршілес Н-тізбектерінің өзара әрекеттесуіне жол бермейтін көптеген пролин қалдықтары бар аймақ бар. Бұл топса аймағы антидене молекуласына икемділік береді. Ауыр және жеңіл тізбектердің айнымалы домендерінің арасында екі бірдей антигенді байланыстыру орындары (антигендерді байланыстыратын белсенді учаскелер) орналасқан, сондықтан мұндай антиденелер жиі деп аталады. биваленттер.Антигеннің антиденемен байланысуы екі тізбектің айнымалы аймақтарының барлық аминқышқылдарының тізбегін қамтымайды, бірақ әрбір тізбектің гипервариативті аймақтарында орналасқан 20-30 аминқышқылдары ғана болады. Дәл осы аймақтар антиденелердің әрбір түрінің сәйкес комплементарлы антигенмен әрекеттесуінің бірегей қабілетін анықтайды.
Антиденелер - ағзаның бөтен организмдердің енуіне қарсы қорғаныс желілерінің бірі. Олардың жұмыс істеуін екі кезеңге бөлуге болады: бірінші кезең - антидене құрылымында антигенді байланыстыру орындарының болуына байланысты мүмкін болатын бөгде организмдердің бетіндегі антигенді тану және байланыстыру; екінші кезең - антигенді инактивациялау және жою процесінің басталуы. Екінші кезеңнің ерекшелігі антиденелер класына байланысты. Тұрақты домендердің құрылымы бойынша бір-бірінен ерекшеленетін ауыр тізбектердің бес класы бар: α, δ, ε, γ және μ, соған сәйкес иммуноглобулиндердің бес класы бөлінеді: A, D, E, G және M.
Ауыр тізбектердің құрылымдық ерекшеліктері ауыр тізбектердің топса аймақтары мен С-терминалды аймақтарына әрбір класқа тән конформациялық сипаттама береді. Антиген антиденемен байланысқаннан кейін тұрақты домендердегі конформациялық өзгерістер антигенді жою жолын анықтайды.
 Күріш. 1. 30. IgG домендік құрылымы
Күріш. 1. 30. IgG домендік құрылымы
Иммуноглобулиндер М
Иммуноглобулиндер М екі нысаны бар.
Мономерлі форма- дамып келе жатқан В-лимфоцит өндіретін антиденелердің 1-ші класы. Кейіннен көптеген В жасушалары антиденелердің басқа кластарын өндіруге ауысады, бірақ антигенді байланыстыру орны бірдей. IgM мембранаға еніп, антигенді тану рецепторы қызметін атқарады. IgM жасуша мембранасына қосылуы аймақтың құйрық бөлігінде 25 гидрофобты амин қышқылы қалдықтарының болуына байланысты мүмкін.
IgM секреторлық формасыбір-бірімен дисульфидтік байланыспен байланысқан бес мономерлі суббірліктер және қосымша полипептидті J-тізбектен тұрады (1.31-сурет). Бұл түрдегі ауыр тізбекті мономерлерде гидрофобты құйрық болмайды. Пентамердің 10 антигенді байланыстыратын орны бар, сондықтан организмге бірінші рет енген антигенді тану және жоюда тиімді. IgM секреторлық түрі біріншілік иммундық жауап кезінде қанға бөлінетін антиденелердің негізгі класы болып табылады. IgM-нің антигенмен байланысуы IgM конформациясын өзгертеді және оның комплемент жүйесінің бірінші белоктық компонентімен байланысуын (комплемент жүйесі – антигеннің бұзылуына қатысатын белоктардың жиынтығы) және осы жүйенің активтенуін индукциялайды. Егер антиген микроорганизмнің бетінде орналасса, комплемент жүйесі тұтастығын бұзады. жасуша мембранасыжәне бактерия жасушасының өлуі.
Иммуноглобулиндер Г
Сандық тұрғыдан алғанда, иммуноглобулиндердің бұл класы қанда басым (барлық Ig-нің 75%). IgG – мономерлер, екіншілік иммундық жауап кезінде қанға бөлінетін антиденелердің негізгі класы. IgG микроорганизмдердің беткі антигендерімен әрекеттескеннен кейін антиген-антидене кешені комплемент жүйесінің ақуыздарын байланыстыруға және белсендіруге қабілетті немесе макрофагтар мен нейтрофилдердегі арнайы рецепторлармен әрекеттесе алады. фагоциттермен әрекеттесу
 Күріш. 1.31. IgM секреторлық формасының құрылымы
Күріш. 1.31. IgM секреторлық формасының құрылымы
антиген-антидене кешендерінің сіңуіне және олардың жасушалардың фагосомаларындағы жойылуына. IgG - бұл плацентарлы тосқауылдан өтіп, ұрықты жатырдағы инфекциялардан қорғай алатын жалғыз антиденелер класы.
Иммуноглобулиндер А
Секрецияда болатын антиденелердің негізгі класы (сүт, сілекей, тыныс алу және ішек секрециялары). IgA негізінен димерлі түрде бөлінеді, мұнда мономерлер бір-бірімен қосымша J-тізбек арқылы байланысады (1.32-сурет).
IgA комплемент жүйесімен және фагоцитарлық жасушалармен әрекеттеспейді, бірақ микроорганизмдермен байланысу арқылы антиденелер олардың эпителий жасушаларына қосылып, организмге енуіне жол бермейді.
Иммуноглобулиндер Е
Е иммуноглобулиндері ауыр ε-тізбектері бар мономерлермен, сондай-ақ М иммуноглобулиндерінің μ-тізбектерімен, бір айнымалы және төрт тұрақты доменмен ұсынылған. IgE секрециядан кейін өздерімен байланысады
 Күріш. 1.32. IgA құрылымы
Күріш. 1.32. IgA құрылымы
Мастикалық жасушалар мен базофилдердің бетінде сәйкес рецепторлары бар С-терминалды аймақтар. Нәтижесінде олар осы жасушалардың бетіндегі антигендердің рецепторларына айналады (1.33-сурет).
 Күріш. 1.33. IgE-нің антигенмен мастикалық жасуша бетіндегі әрекеттесуі
Күріш. 1.33. IgE-нің антигенмен мастикалық жасуша бетіндегі әрекеттесуі
Антиген сәйкес антигенді байланыстыратын IgE учаскелеріне бекітілгеннен кейін жасушалар қабыну реакциясының дамуына және аллергиялық реакциялардың көрінісіне жауап беретін биологиялық белсенді заттардың (гистамин, серотонин) бөлінуіне сигнал алады. демікпе, есекжем, шөп безгегі.
Иммуноглобулиндер D
D иммуноглобулиндері сарысуда өте аз мөлшерде кездеседі, олар мономерлер. Ауыр δ тізбектерде бір айнымалы және үш тұрақты домен болады. IgD В-лимфоциттердің рецепторлары ретінде әрекет етеді, басқа функциялары әлі белгісіз. Арнайы антигендердің В-лимфоциттердің (IgD) бетіндегі рецепторлармен әрекеттесуі бұл сигналдардың жасушаға берілуіне және лимфоциттердің осы клонының көбеюін қамтамасыз ететін механизмдердің белсендірілуіне әкеледі.
ТАҚЫРЫП 1.7. БЕЛГІЛЕРДІҢ ФИЗИКАЛЫҚ-ХИМИЯЛЫҚ ҚАСИЕТТЕРІ ЖӘНЕ ОЛАРДЫ БӨЛУ ӘДІСТЕРІ.
1. Жеке белоктар физикалық-химиялық қасиеттері бойынша ерекшеленеді:
Молекулалардың пішіні;
Молекулярлық салмақ;
Жалпы заряд, оның мәні аминқышқылдарының анионды және катиондық топтарының қатынасына байланысты;
Молекулалар бетіндегі полярлы және полярсыз аминқышқылдарының радикалдарының қатынасы;
Әртүрлі денатурациялаушы агенттерге төзімділік дәрежелері.
2. Белоктардың ерігіштігі тәуелдіжоғарыда аталған белоктардың қасиеттері туралы, сондай-ақ белок еритін ортаның құрамы туралы (рН мәндері, тұз құрамы, температура, ақуызбен әрекеттесе алатын басқа органикалық заттардың болуы). Белок молекулаларының зарядының шамасы олардың ерігіштігіне әсер ететін факторлардың бірі болып табылады. Заряд изоэлектрлік нүктеде жоғалған кезде белоктар оңайырақ біріктіріліп, тұнбаға түседі. Бұл әсіресе бетінде гидрофобты аминқышқылдарының радикалдары бар денатуратталған ақуыздарға қатысты.
Белок молекуласының бетінде оң және теріс зарядталған аминқышқылдарының радикалдары болады. Бұл топтардың саны, демек, белоктардың жалпы заряды ортаның рН-ына байланысты, яғни. Н + - және ОН - топтарының концентрациясының қатынасы. Қышқыл ортада H+ концентрациясының жоғарылауы карбоксил топтарының -COO - + H+ > -COOH диссоциациясының басылуына және белоктардың теріс зарядының төмендеуіне әкеледі. Сілтілік ортада амин топтарының -NH 3 + + OH - - NH 2 + H 2 O диссоциациясы кезінде түзілетін артық OH - протондардың судың түзілуімен байланысуы белоктардың оң зарядының төмендеуіне әкеледі. Ақуыздың таза заряды нөлге тең болатын рН мәні деп аталады изоэлектрлік нүкте (IEP). IET-те оң және теріс зарядталған топтардың саны бірдей, яғни. белок изоэлектрлік күйде болады.
3. Жеке белоктардың бөлінуі.Организмнің құрылымы мен қызмет ету ерекшеліктері онда синтезделген белоктардың жиынтығына байланысты. Белоктардың құрылысы мен қасиеттерін зерттеу оларды жасушадан бөліп алып, басқа белоктар мен органикалық молекулалардан тазартпай мүмкін емес. Жеке белоктарды бөліп алу және тазарту кезеңдері:
жасушаның жойылуызерттелетін тіннің және гомогенатты алу.
Гомогенатты фракцияларға бөлуцентрифугалау, қажетті ақуызды қамтитын ядролық, митохондриялық, цитозолдық немесе басқа фракцияны алу.
Селективті жылулық денатурация- белок ерітіндісін қысқа мерзімді қыздыру, онда денатуратталған ақуыз қоспаларының бір бөлігін жоюға болады (ақуыз салыстырмалы түрде термиялық тұрақты болған жағдайда).
Тұздану.Әртүрлі ақуыздар ерітіндідегі тұздың әртүрлі концентрациясында тұнбаға түседі. Тұз концентрациясын бірте-бірте арттыра отырып, олардың біреуінде бөлінетін белок басым болатын бірқатар жеке фракцияларды алуға болады. Белоктардың ең көп қолданылатын фракциясы аммоний сульфаты болып табылады. Төмен ерігіштігі бар белоктар тұздың төмен концентрациясында тұнбаға түседі.
Гельді сүзу- ісінген Sephadex түйіршіктері (кеуектері бар үш өлшемді декстран полисахаридті тізбектер) арқылы молекулаларды елеуіш әдісі. Белоктардың Sephadex толтырылған колонка арқылы өту жылдамдығы олардың молекулалық салмағына байланысты болады: ақуыз молекулаларының массасы неғұрлым аз болса, олар түйіршіктерге оңай еніп, оларда ұзағырақ қалады, массасы неғұрлым үлкен болса, олар соғұрлым тезірек бөлінеді. баған.
Ультрацентрифугалау- центрифугалық түтіктегі ақуыздардың ультрацентрифуганың роторына орналастырылуынан тұратын әдіс. Ротор айналу кезінде белоктардың шөгу жылдамдығы олардың молекулалық салмағына пропорционалды болады: ауыр белоктардың фракциялары түтік түбіне жақын орналасады, жеңілдері бетіне жақынырақ.
электрофорез- электр өрісіндегі белоктардың қозғалыс жылдамдығының айырмашылығына негізделген әдіс. Бұл мән белоктардың зарядына пропорционал. Ақуыз электрофорезі қағазда (бұл жағдайда белоктардың қозғалу жылдамдығы тек олардың зарядына пропорционалды) немесе белгілі бір кеуек өлшемі бар полиакриламидті гельде (белоктардың қозғалыс жылдамдығы олардың заряды мен молекулалық массасына пропорционал) жүргізіледі. ).
Ион алмасу хроматографиясы- белоктардың иондалған топтарын ион алмастырғыш шайырлардың (ерімейтін полимерлі материалдар) қарама-қарсы зарядталған топтарымен байланыстыруға негізделген фракциялау әдісі. Ақуыздың шайырмен байланысу күші ақуыздың зарядына пропорционал. Ион алмастырғыш полимерге адсорбцияланған белоктарды NaCl ерітінділерінің концентрациясының жоғарылауымен жууға болады; ақуыз заряды неғұрлым төмен болса, шайырдың иондық топтарымен байланысқан ақуызды жуу үшін NaCl концентрациясының төмен болуы қажет болады.
Сәйкестік хроматографиясы- жеке белоктарды бөліп алудың ең спецификалық әдісі.Белоктың лигандасы инертті полимерге ковалентті байланысады. Белок ерітіндісін полимері бар колонка арқылы өткізгенде, белоктың лигандпен комплементарлы байланысуына байланысты колоннаға тек осы лигандқа тән ақуыз ғана адсорбцияланады.
Диализ- оқшауланған ақуыз ерітіндісінен төмен молекулалық қосылыстарды жою үшін қолданылатын әдіс. Әдіс белоктардың төмен молекулалы заттарға қарағанда жартылай өткізгіш мембранадан өте алмауына негізделген. Ол ақуыздарды төмен молекулалық қоспалардан, мысалы, тұздан кейін тұздардан тазарту үшін қолданылады.
СЫНЫПТАН ТЫС ЖҰМЫСТАРҒА ТАПСЫРМАЛАР
1. Кестені толтыру. 1.4.
1.4-кесте. Салыстырмалы талдаутуыстас белоктардың – миоглобин мен гемоглобиннің құрылымдары мен қызметтері
а) белсенді орталықтың құрылымын есте сақтаңыз Mb және Hb. Аминқышқылдарының гидрофобты радикалдары осы белоктардың белсенді орталықтарының түзілуінде қандай рөл атқарады? Mb және Hb белсенді орталығының құрылымын және оған лигандтардың қосылу механизмдерін сипаттаңыз. Оның F 8 және Оның E 7 қалдықтары Mv және Hv белсенді учаскесінің қызметінде қандай рөл атқарады?
б) мономерлі миоглобинмен салыстырғанда бір-бірімен тығыз байланысты олигомерлі ақуыз гемоглобиннің қандай жаңа қасиеттері бар? Гемоглобин молекуласындағы протомерлердің конформациясындағы кооперативтік өзгерістердің рөлін, СО 2 мен протон концентрациясының гемоглобиннің оттегіге жақындығына әсерін және Hb функциясының аллостериялық реттелуіндегі 2,3-ВПГ рөлін түсіндіріңіз.
2. Молекулярлық шаперондардың құрылымы мен қызметі арасындағы байланысқа назар аудара отырып, олардың сипаттамаларын сипаттаңыз.
3. Қандай белоктар тұқымдастарға топтастырылған? Иммуноглобулиндер тұқымдасына мысал келтіре отырып, осы тұқымдас белоктардың ұқсас құрылымдық ерекшеліктерін және оларға байланысты қызметтерін анықтаңыз.
4. Көбінесе биохимиялық және медициналық мақсаттар үшін тазартылған жеке ақуыздар қажет. Белоктардың қандай физика-химиялық қасиеттеріне негізделген оларды бөлу және тазарту әдістерін түсіндіріңіз.
ӨЗІН-ӨЗІ БАҚЫЛАУ Тапсырмалары
1. Дұрыс жауаптарды таңдаңыз.
Гемоглобиннің функциялары:
A. O 2 өкпеден ұлпаларға тасымалданады B. H + ұлпалардан өкпеге тасымалданады
B. Тұрақты қан рН деңгейін ұстап тұру D. СО2 өкпеден ұлпаларға тасымалдануы
D. СО 2-нің ұлпалардан өкпеге тасымалдануы
2. Дұрыс жауаптарды таңдаңыз. лигандα -Hb протомері:А. Хеме
B. Оттегі
B. CO D. 2,3-BPG
D. β-протомер
3. Дұрыс жауаптарды таңдаңыз.
Гемоглобиннің миоглобиннен айырмашылығы:
A. Төрттік құрылымы бар
B. Қосалқы құрылым тек α-спиральдармен берілген
B. Күрделі белоктарға жатады
D. Аллостериялық лигандпен әрекеттеседі D. Геммен ковалентті байланысқан
4. Дұрыс жауаптарды таңдаңыз.
Hb-ның O 2-ге жақындығы төмендейді:
A. Бір O 2 молекуласы қосылғанда B. Бір O 2 молекуласы жойылғанда
B. 2,3-BPG-мен әрекеттесу кезінде
D. H+D протомерлеріне қосылғанда. 2,3-БПГ концентрациясы төмендегенде
5. Сәйкестік орнату.
Hb типтері үшін ол тән:
A. Дезокси түрінде фибриллярлы агрегаттар түзеді B. Құрамында екі α- және екі δ-тізбектері бар.
B. Ересек эритроциттерде Hb басым түрі D. Белсенді орталығында Fe+3 бар гем бар.
D. Құрамында екі α- және екі γ-тізбектері бар 1. HvA 2.
6. Сәйкестік орнату.
Лигандалар Hb:
A. Аллостериялық орталықта Hb-мен байланысады
B. Белсенді Hb сайтына өте жоғары жақындығы бар
B. Қосылу, Hb-ның O 2-ге жақындығын арттырады D. Fe + 2-ні Fe + 3-ке тотықтырады.
D. Пішіндер коваленттік байланыс hysF8 көмегімен
7. Дұрыс жауаптарды таңдаңыз.
Каперондар:
A. Жасушаның барлық бөліктерінде болатын белоктар
B. Стресстік әсерлер кезінде синтез күшейеді
B. Денатуратталған белоктардың гидролизіне қатысады
D. Белоктардың нативті конформациясын сақтауға қатысу
D. Белок конформациясы түзілетін органоидтарды жасаңыз
8. Сәйкестік. Иммуноглобулиндер:
A. Секреторлық формасы бесжылдық
B. Плацентарлы тосқауылдан өтетін Ig класы
B. Ig - діңгек жасушаларының рецепторы
D. Эпителий жасушаларының секрецияларында болатын Ig негізгі класы. D. В-лимфоциттік рецептор, оның активтенуі жасушаның көбеюін қамтамасыз етеді
9. Дұрыс жауаптарды таңдаңыз.
Иммуноглобулиндер Е:
A. Макрофагтар түзеді B. Ауыр ε-тізбектері бар.
B. Т-лимфоциттердің жарғақшасына енген
D. Мастикалық жасушалар мен базофилдердегі антигендер үшін мембраналық рецепторлар ретінде әрекет етеді
D. Аллергиялық реакциялардың көрінісіне жауапты
10. Дұрыс жауаптарды таңдаңыз.
Белоктарды бөлу әдісі олардың молекулалық салмағының айырмашылығына негізделген:
A. Гельді сүзу
B. Ультрацентрифугалау
B. Полиакриламидті гельдік электрофорез D. Ион алмасу хроматографиясы
D. Афинитті хроматография
11. Дұрыс жауапты таңда.
Ақуыздарды бөлу әдісі олардың судағы ерігіштігінің айырмашылығына негізделген:
A. Гельді сүзу B. Тұздану
B. Ион алмасу хроматографиясы D. Афинитті хроматография
E. Полиакриламидті гельді электрофорез
«ӨЗІН-ӨЗІ БАҚЫЛАУ ТАПСЫРМАЛАРЫНА» ЖАУАП БЕРУ СТАНДАРТтары
1. A, B, C, D
2. A, B, C, D
5. 1-В, 2-А, 3-Г
6. 1-С, 2-Б, 3-А
7. A, B, D, D
8. 1-G; 2-В, 3-С
НЕГІЗГІ ТЕРМИНДЕР МЕН ТҮСІНІКТЕР
1. Олигомерлі белоктар, протомер, белоктардың төрттік құрылымы
2. Протомер конформациясындағы кооперативтік өзгерістер
3. Бор эффектісі
4. Белок функцияларының аллостериялық реттелуі, аллостериялық орталық және аллостериялық эффектор
5. Молекулярлық шаперондар, жылу соққысының белоктары
6. Белок тұқымдастары (сериндік протеазалар, иммуноглобулиндер)
7. IgM-, G-, E-, A- құрылымның функциямен байланысы
8. Белоктардың толық заряды, белоктардың изоэлектрлік нүктесі
9. Электрофорез
10. Тұзды шығару
11. Гельді фильтрация
12. Ион алмасу хроматографиясы
13. Ультрацентрифугалау
14. Афинитті хроматография
15. Плазма ақуызының электрофорезі
АУДИЦИЯ ЖҰМЫСЫНА АРНАЛҒАН ТАПСЫРМАЛАР
1. Гемоглобин (Нв) мен миоглобиннің (Мб) оттегімен қанығу дәрежесінің оның ұлпалардағы парциалды қысымына тәуелділігін салыстырыңыз.
 Күріш. 1.34. МВ-ның қанығуға тәуелділігі жәнеHbоның парциалды қысымынан оттегі
Күріш. 1.34. МВ-ның қанығуға тәуелділігі жәнеHbоның парциалды қысымынан оттегі
Ақуыздың оттегімен қанығу қисықтарының пішіні әртүрлі екенін ескеріңіз: миоглобин үшін - гипербола, гемоглобин үшін - сигма тәрізді пішін.
1. Mb және Hb O 2-ге 50% қаныққан оттегінің парциалды қысымының мәндерін салыстырыңыз. Осы белоктардың қайсысының O 2-ге жақындығы жоғары?
2. МБ қандай құрылымдық ерекшеліктері оның O 2-ге жоғары жақындығын анықтайды?
3. Hb-ның қандай құрылымдық ерекшеліктері тыныштықтағы тіндердің капиллярларында (О 2 салыстырмалы жоғары парциалды қысымда) О 2-ні босатуға және жұмыс істейтін бұлшықеттерде бұл қайтарымды күрт арттыруға мүмкіндік береді? Бұл әсерді олигомерлі белоктардың қандай қасиеті қамтамасыз етеді?
4. Тыныштықтағы және жұмыс істейтін бұлшықетке оттегімен қаныққан гемоглобинді қандай мөлшерде О 2 (%-бен) беретінін есептеңіз?
5. ақуыз құрылымы мен оның қызметі арасындағы байланыс туралы қорытынды жасау.
2. Капиллярлардағы гемоглобин бөлетін оттегінің мөлшері тіндердегі катаболизм процестерінің қарқындылығына байланысты (Бор эффектісі). Тіндердің метаболизміндегі өзгерістер Hb-ның O 2-ге жақындығын қалай реттейді? CO 2 және H+ Hb-ның O 2-ге жақындығына әсері
 1. Бор эффектісін сипаттаңыз.
1. Бор эффектісін сипаттаңыз.
2. диаграммада көрсетілген процесс қай бағытта жүреді?
а) өкпе капиллярларында;
б) ұлпа капиллярларында?
3. Бор эффектінің физиологиялық маңызы қандай?
4. Неліктен гемнен қашық орналасқан жерлерде Hb-ның Н+-мен әрекеттесуі ақуыздың O 2-ге жақындығын өзгертеді?
3. Hb-ның O 2-ге жақындығы оның лигандының, 2,3-бифосфоглицераттың концентрациясына байланысты, ол Hb-ның O 2-ге жақындығының аллостериялық реттеушісі болып табылады. Неліктен белсенді аймақтан қашықтағы тораптағы лигандтардың өзара әрекеттесуі ақуыз қызметіне әсер етеді? 2,3-BPG Hb-ның O 2-ге жақындығын қалай реттейді? Мәселені шешу үшін келесі сұрақтарға жауап беріңіз:
1. 2,3-бифосфоглицерат (2,3-БПГ) қайдан және неден синтезделеді? Оның формуласын жаз, осы молекуланың зарядын көрсет.
2. БПГ гемоглобиннің қандай формасымен (окси немесе дезокси) әрекеттеседі және неліктен? Hb молекуласының қай аймағында әрекеттесу жүреді?
3. сызбада көрсетілген процесс қай бағытта жүреді?
а) ұлпа капиллярларында;
б) өкпе капиллярларында?
4. қай жерде көбірек болуы керек жоғары концентрациякешен
Nv-2,3-BFG:
а) тыныштықтағы бұлшықет капиллярларында;
б) жұмыс істейтін бұлшықеттердің капиллярларында (эритроциттерде BPG бірдей концентрациясын есептегенде)?
5. Эритроциттердегі БПГ концентрациясы жоғарыласа, адам биіктік жағдайына бейімделген кезде Hb оттегіге жақындығы қалай өзгереді? Бұл құбылыстың физиологиялық маңызы қандай?
4. Консервіленген қанды сақтау кезінде 2,3-БПГ-ның бұзылуы Hb функцияларын бұзады. Егер эритроциттердегі 2,3-БПГ концентрациясы 8-ден 0,5 ммоль/л-ге дейін төмендеуі мүмкін болса, сақталған қандағы Hb-ның O 2-ге жақындығы қалай өзгереді. 2,3-БПГ концентрациясы үш күннен ерте емес қалпына келтірілсе, ауыр науқастарға мұндай қанды құюға болады ма? Қанға 2,3-БПГ қосу арқылы эритроциттердің қызметін қалпына келтіруге болады ма?
5. Ең қарапайым иммуноглобулин молекулаларының құрылымын еске түсіріңіз. Иммуноглобулиндер иммундық жүйеде қандай рөл атқарады? Неліктен Igs жиі бивалентті деп аталады? Igs құрылымы олардың қызметімен қалай байланысты? (Иммуноглобулиндер класының мысалын пайдаланып сипаттаңыз.)
Белоктардың физика-химиялық қасиеттері және оларды бөлу әдістері.
6. Ақуыздың таза заряды оның ерігіштігіне қалай әсер етеді?
а) рН 7 кезінде пептидтің жалпы зарядын анықтаңыз
Ala-Glu-Tre-Pro-Asp-Liz-Cis
б) рН >7, рН кезінде осы пептидтің заряды қалай өзгереді<7, рН <<7?
в) белоктың изоэлектрлік нүктесі (ИЭП) қандай және ол қандай ортада орналасады
Осы пептидтің IET?
г) қандай рН шамасында осы пептидтің ең аз ерігіштігі байқалады.
7. Неліктен қышқыл сүт, жаңа піскен сүтке қарағанда, қайнатқанда «ұйытады» (яғни, казеин сүт ақуызы тұнбаға түседі)? Жаңа сүттегі казеин молекулаларының теріс заряды бар.
8. Гельді фильтрация жеке белоктарды бөлу үшін қолданылады. Құрамында молекулалық массалары сәйкесінше 160 000, 80 000 және 60 000-ға тең А, В, С белоктары бар қоспа гельді фильтрация арқылы талданған (1.35-сурет). Ісінген гель түйіршіктері молекулалық массасы 70000-нан аз белоктарды өткізеді.Бұл бөлу әдісінің негізінде қандай принцип жатыр? Графиктердің қайсысы бөлшектеу нәтижелерін дұрыс көрсетеді? А, В және С белоктарының бағаннан шығу ретін көрсетіңіз.
 Күріш. 1.35. Протеиндерді бөлу үшін гельді сүзу әдісін пайдалану
Күріш. 1.35. Протеиндерді бөлу үшін гельді сүзу әдісін пайдалану
9. Суретте. 1.36, А сау адамның қан сарысуындағы ақуыздардың қағаздағы электрофорез сызбасын көрсетеді. Бұл әдіс арқылы алынған ақуыз фракцияларының салыстырмалы мөлшері: альбуминдер 54-58%, α 1 -глобулиндер 6-7%, α 2 -глобулиндер 8-9%, β-глобулиндер 13%, γ-глобулиндер 11-12% .
 Күріш. 1.36 Сау адамның (А) және науқастың (В) қан плазмасының ақуыздарының қағаздағы электрофорезі
Күріш. 1.36 Сау адамның (А) және науқастың (В) қан плазмасының ақуыздарының қағаздағы электрофорезі
I – γ-глобулиндер; II – β-глобулиндер; III -α 2 - глобулин; IV-α 2 - глобулин; V – альбуминдер
Көптеген аурулар сарысу ақуыздарының құрамындағы сандық өзгерістермен (диспротеинемия) жүреді. Бұл өзгерістердің сипаты диагноз қою және аурудың ауырлығы мен сатысын бағалау кезінде ескеріледі.
Кестеде берілген мәліметтерді пайдалану. 1.5, суретте көрсетілген электрофоретикалық профильмен сипатталатын ауру туралы болжам жасаңыз. 1.36.
1.5-кесте. Патологияда қан сарысуындағы ақуыздардың концентрациясының өзгеруі
Биохимия- Бұл тіршіліктің молекулалық негіздері туралы ғылым, ол организмнің тірі жасушаларында болатын молекулаларды, химиялық реакцияларды, процестерді зерттеумен айналысады. Бөлінген:
статикалық (биомалекулалардың құрылымы мен қасиеттері)
динамикалық (реакциялар химиясы)
арнайы бөлімдер (экологиялық, микроорганизмдер биохимиясы, клиникалық)
Медициналық іргелі мәселелерді шешудегі биохимияның рөлі
адам денсаулығын сақтау
түрлі аурулардың себептерін анықтау және оларды тиімді емдеу жолдарын табу.
Осылайша, адамның кез келген әлсіреу, ауруы метаболиттер немесе биомолекулалардың құрылымы мен қасиеттерінің бұзылуымен байланысты, сонымен қатар организмде болатын биохимиялық реакциялардың өзгеруімен байланысты. Кез келген емдеу әдістерін, препараттарды қолдану олардың әрекетінің биохимиясын түсінуге және дәл білуге негізделген.
Белоктар, олардың құрылысы және биологиялық рөлі
Белоктар жоғары молекулалы полипептидтер, белоктар мен полипептидтер арасындағы шартты шекара әдетте 8000-10000 молекулалық салмақ бірлігін құрайды. Полипептидтер – бір молекулада 10-нан астам амин қышқылы қалдықтары бар полимерлі қосылыстар.
Пептидтер – екі немесе одан да көп аминқышқылдарының қалдықтарынан тұратын қосылыстар (10-ға дейін).Белоктарда тек L-амин қышқылдары болады.
Амин қышқылдарының туындылары бар, мысалы, коллаген құрамында гидроксипролин мен гидроксилизин бар. Кейбір белоктарда γ-карбоксиглутамат кездеседі. Протромбиндегі глутаматтың карбоксилденуінің бұзылуы қан кетуге әкелуі мүмкін. Фосфоросерин белоктарда жиі кездеседі.
Маңызды амин қышқылдары - бұл организмде синтезделмейтін немесе
жеткіліксіз мөлшерде немесе төмен жылдамдықпен синтезделген.
Адам үшін қажет 8 аминқышқылдары: триптофан, фенилаланин,
метионин, лизин, валин, треонин, изолейцин, лейцин.
Амин қышқылдарының биохимиялық қызметі:
пептидтердің, полипептидтердің және ақуыздардың құрылыс блоктары,
басқа аминқышқылдарының биосинтезі (тирозин фенилаланиннен синтезделеді, цистеин метиониннен синтезделеді)
Кейбір гормондардың биосинтезі, мысалы, окситацин, вазопрессин, инсулин
глутатион, креатин түзуге арналған бастапқы өнімдер
глицин порфирин синтезі үшін маңызды
p - аланин, валин, цистеин КоА, триптофан - никотинамид, глутамин қышқылы - фолий қышқылы
нуклеотидтер биосинтезі үшін глутамин, глицин, аспарагин қышқылы қажет, олар пуриндік негіздер, глутамин және аспарагин қышқылы – пиримидин түзеді.
11 аминқышқылдары глюкогенді болып табылады, яғни олар глюкозаға және басқа көмірсуларға метаболизденеді.
фенилаланин, тирозин, лейцин, лизин және триптофан кейбір липидтердің биосинтезіне қатысады.
10. АТФ түріндегі мочевина, көмірқышқыл газы және энергияның түзілуі.
Белоктардың құрылымы. бастапқы құрылым.
Бастапқы құрылым астында аминқышқылдарының тізбектегі реттілігін түсінеді, олар өзара ковалентті пептидтік байланыстармен байланысады. Полипептидтік тізбек бос амин тобы (N - соңы) бар қалдықтан басталып, бос COOH - ұшымен аяқталады.
Бастапқы құрылымға дисульфидті байланыстардың түзілуімен цистеин қалдықтарының өзара әрекеттесуі де кіреді.
Сонымен, бастапқы құрылым белок молекуласындағы барлық коваленттік байланыстардың сипаттамасы болып табылады.
Пептидтік байланыс полярлығымен ерекшеленеді, бұл N және C арасындағы байланыстың жартылай қос байланыс сипатына ие болуына байланысты. Айналу қиын және пептидтік байланыс қатты құрылымға ие. Аминқышқылдарының тізбегі қатаң генетикалық түрде анықталады, ол ақуыздың табиғи табиғатын және оның ағзадағы қызметін анықтайды.
қосалқы құрылым
1951 ж. – қайталама құрылым дешифрленген (таяқшаның ішкі бөлігін құрайтын полипептидтің негізгі тізбегі тығыз бұралған, бүйірлік тізбектері сыртқа бағытталған, спираль түрінде орналасқан) Негіздердің барлық -C=O-N-H- топтары. тізбегі сутегі байланыстары арқылы байланысады.
Сутегі байланыстары а-спиральді тұрақты етеді.
Екінші реттік құрылымның тағы бір түрі p - қатпарлы қабат. Бұл сутегі байланыстары арқылы өзара байланысқан параллельді полипептидтік тізбектер. Мұндай p-түзілімдердің бұралуы мүмкін, бұл ақуызға үлкен күш береді.
Екінші реттік құрылымның үшінші түрі коллагенге тән. Коллаген прекурсорының (тропоколлаген) үш полипептидтік тізбегінің әрқайсысы спираль тәрізді. Осындай үш спиральданған тізбек бір-біріне қатысты бұралып, тығыз жіпті құрайды.
Құрылымның бұл түрінің ерекшелігі таза глицин, пролин және гидроксипролин қалдықтары арасындағы сутектік байланыстардың, сондай-ақ молекулаішілік және молекулааралық коваленттік айқаспалы байланыстардың болуына байланысты.
МӘДЕНИЕТ, БІЛІМ ЖӘНЕ ДЕНСАУЛЫҚ САҚТАУ МИНИСТРЛІГІ
ҚАЗАҚСТАН РЕСПУБЛИКАСЫ
ПАВЛОДАР УНИВЕРСИТЕТІ
БИОЛОГИЯ КАФЕДРАСЫ
БАҚЫЛАУ ЖҰМЫСЫ
Тақырыбы: «Биохимия»
Аяқталды
Павлодар, 2004 ж
1. Тірі ағзалардағы су. Судың құрылысы мен қасиеттері.
2. Нуклеин қышқылдарының құрамына кіретін пуриндік және пиримидиндік негіздердің құрылымдық формулалары.
3. Ферменттердің қасиеттері, ферменттердің әсер ету ерекшелігі. Денатуратталған белок пен нативті ақуыздың айырмашылығы.
4. Д витамині, осы витаминнің витаминдері. Авитаминоз белгілері D. Д витаминінің табиғи көздері.
5. D-глюкозаның дихотомиялық ыдырау схемасы (гликолиз).
6. Пептид-валил-изолейцил-метионил-аргениннің құрылымдық формуласы.
Біздің планетамыздағы барлық тіршілік иелерінің 2/3 бөлігі судан тұрады. Микроорганизмдер массасы бойынша тірі затта бірінші орында, өсімдіктер екінші орында, жануарлар үшінші орында, адамдар соңғы орында. Бактериялар 81 пайыз. Олар судан, споралардан – 50 пайыз, жануарлар ұлпаларында орта есеппен 70 пайыз, лимфа – 90 пайыз, қанда 79 пайызға жуық болады. Судағы ең бай ұлпа көздің шыны тәрізді денесі болып табылады, оның құрамында 99 пайызға дейін бар. ылғалдылығы, ең нашары – тіс эмалы – 0,2 пайыз ғана.
Ағзадағы су бірнеше функцияларды орындайды: онда еріген заттар бір-бірімен әрекеттеседі, су зат алмасу қалдықтарын кетіруге көмектеседі, температураны реттегіш, жақсы жылу тасымалдағыш, сонымен қатар майлаушы ретінде қызмет етеді.
Тірі организмдерде суды ұлпаларда синтездеуге болады. Мәселен, түйенің өркешіндегі майы тотыққанда 40 литрге дейін су береді. Күніне 2,5 литр су ішкен адам күніне 10 литр сұйықтықпен асқазанын шайып, 0,7 литр суды буландырады.
Жасушалардың химиялық құрамын зерттеу тірі организмдерде тек оларға ғана тән ерекше химиялық элементтердің болмайтынын көрсетеді: жанды және жансыз табиғаттың химиялық құрамының бірлігі осында көрінеді.
Жасушадағы химиялық элементтердің рөлі үлкен: N және S белоктардың құрамына кіреді, Р ДНҚ мен РНҚ-да, Mg көптеген ферменттер мен хлорофилл молекуласының құрамына кіреді, Cu көптеген тотығу ферменттерінің құрамына кіреді, Zn ұйқы безі. гормон, Fe – гемоглобин молекуласы, I – тироксин гормоны, т.б. Жасуша үшін ең маңыздысы – HPO42-, H2RO4-, CO32-, Cl-, HCO3- аниондары және Na+, K+, Ca2+ катиондары.
Жасушадағы катиондар мен аниондардың мөлшері олардың жасушаны қоршап тұрған ортадағы концентрациясынан ерекшеленеді, бұл мембрана арқылы заттардың тасымалдануын белсенді реттеуге байланысты. Бұл тірі жасушаның химиялық құрамының тұрақтылығын қамтамасыз етеді. Жасуша өлген кезде ортадағы және цитоплазмадағы заттардың концентрациясы төмендейді. Бейорганикалық қосылыстардың ішінде су, минералды тұздар, қышқылдар және негіздер маңызды.
Жұмыс істеп тұрған жасушадағы су оның көлемінің 80%-ын алады және онда екі түрде кездеседі: бос және байланысқан. Байланысқан судың молекулалары белоктармен тығыз байланысып, олардың айналасында су қабықшаларын құрайды, белоктарды бір-бірінен оқшаулайды. Су молекулаларының полярлығы, сутектік байланыс түзу қабілеті оның жоғары меншікті жылу сыйымдылығын түсіндіреді. Осының нәтижесінде тірі жүйелерде температураның күрт ауытқуына жол берілмейді, ал жылу жасуша ішінде бөлініп, бөлінеді. Байланысқан судың арқасында жасуша төмен температураға төтеп бере алады. Оның жасушадағы мөлшері шамамен 5%, ал 95% бос су. Соңғысы алмасуда жасушаға қатысатын көптеген заттарды ерітеді.
Ми тіндері сияқты жоғары белсенді жасушаларда су шамамен 85%, ал бұлшықеттерде 70% -дан астам; май тіндері сияқты белсенді емес жасушаларда су оның массасының шамамен 40% құрайды. Тірі организмдерде су көптеген заттарды ерітіп қана қоймайды; оның қатысуымен гидролиз реакциялары жүреді - органикалық қосылыстардың аралық және соңғы заттарға ыдырауы.
Зат
Ұяшыққа кіру
Орналасқан жері және трансформациясы
Қасиеттер
Өсімдіктерде – қоршаған ортадан; кезінде жануарларда тікелей жасушада түзіледі
көмірсулар және қоршаған ортадан келеді
Цитоплазмада, вакуольдер, органеллалар матрицасы, ядро шырыны, жасуша қабырғасы, жасушааралық кеңістіктер. Синтез, гидролиз және тотығу реакцияларына қатысады
Еріткіш. Оттегі көзі, осмостық реттегіш, физиологиялық және биохимиялық процестердің ортасы,
химиялық компонент, терморегулятор
Әртүрлі органикалық заттар тотыққанда әртүрлі мөлшерде су түзетінін атап өткен жөн. Сутегідегі органикалық заттардың молекуласы неғұрлым бай болса, оның тотығуы кезінде соғұрлым көп су түзіледі. 100 г май тотыққанда 107 мл су, 100 г көмірсу – 55 мл су, 100 г белок – 41 мл су түзіледі.
Адам ағзасының суға деген тәуліктік қажеттілігі 1 кг дене салмағына шамамен 40 г суды құрайды. Нәрестелерде 1 кг салмаққа су қажеттілігі ересектерге қарағанда үш-төрт есе жоғары.
Тірі организмдердегі су тек тасымалдау қызметін атқарып қоймай, зат алмасу процестерінде де қолданылады. Судың органикалық заттарға кең көлемде қосылуы жасыл өсімдіктерде кездеседі, оларда көмірсулар, белоктар, липидтер және басқа да органикалық заттар күн энергиясын пайдаланып судан, көмірқышқыл газынан және минералды азотты заттардан синтезделеді.
Ағзаға судың ағуы шөлдеу сезімімен реттеледі. Қанның қоюлануының алғашқы белгілерінде ми қыртысының белгілі бір бөліктерінің рефлекторлық қозуының нәтижесінде шөлдеу пайда болады - ішуге ұмтылу. Тіпті көп мөлшерде суды бір уақытта тұтынған кезде қан бірден сумен байымайды, ол сұйылмайды. Бұл қандағы судың жасушааралық кеңістіктерге тез еніп, жасушааралық судың мөлшерін көбейтуімен түсіндіріледі. Қанға және ішінара ішектен лимфаға сіңген су көп мөлшерде теріге еніп, біраз уақыт сонда қалады. Сондай-ақ бауыр ағзаға түскен судың белгілі бір мөлшерін сақтайды.
Ағзадан су негізінен бүйрекпен, несеппен, аз мөлшерде ішек қабырғаларымен, содан кейін тер бездерімен (тері арқылы) және дем шығарылған ауамен өкпе арқылы шығарылады. Ағзадан шығарылатын су мөлшері тұрақты емес. Күшті терлеу кезінде тәулігіне 5 немесе одан да көп литр су денеден термен бірге шығарылуы мүмкін. Бұл жағдайда бүйрек арқылы шығарылатын судың мөлшері азаяды, зәр қалыңдайды. Ішімдік ішу шектелген кезде зәр шығаруды азайтады. Дегенмен, зәрдің қоюлануы белгілі бір шекке дейін мүмкін, ал ішуді одан әрі шектеумен азот алмасуының соңғы өнімдері мен минералды заттардың ағзадан шығарылуы кешіктіріледі, бұл дененің өмірлік белсенділігіне теріс әсер етеді. Денедегі судың көп мөлшерімен зәр шығару артады.
Табиғаттағы су. Су - жер бетінде өте кең таралған зат. Жер шарының 3 4 дерлік беті сумен жабылып, мұхиттарды, теңіздерді, өзендер мен көлдерді құрайды. Судың көп бөлігі атмосферада бу ретінде газ күйінде болады; қар мен мұздың үлкен массасы түрінде ол жыл бойы биік таулардың шыңдарында және полярлық елдерде жатыр. Жер қойнауында топырақ пен тасты сіңдіретін су да бар.
Өсімдіктер, жануарлар және адам өмірінде судың маңызы зор. Заманауи түсініктерге сәйкес, тіршіліктің пайда болуының өзі теңізбен байланысты. Кез келген организмде су – организмнің тіршілік әрекетін қамтамасыз ететін химиялық процестер жүретін орта; Сонымен қатар, ол өзі бірқатар биохимиялық реакцияларға қатысады.
Таза су – түссіз мөлдір сұйықтық. Өтпелі кезеңдегі судың тығыздығы оныңқатты күйден сұйық күйге дейін барлық дерлік заттар сияқты төмендемейді, бірақ жоғарылайды. Су 0-ден қызған кезде бұрын 4 Оның тығыздығы да артады. 4 С температурада судың максималды тығыздығы бар, тек одан әрі қыздырғанда ғана оның тығыздығы төмендейді.
Табиғат өмірінде судың маңызы зор. аномальды жоғары жылу сыйымдылығы бар, Сондықтан түнде, сондай-ақ жаздан қысқа көшу кезінде су баяу салқындайды, ал күндіз немесе қыстан жазға ауысу кезінде ол баяу қызады, осылайша температура жер шарындағы реттеуші.
Су молекуласының бұрыштық құрылымы бар; оның құрамына кіретін ядролар тең қабырғалы үшбұрышты құрайды, оның негізінде екі протон, ал жоғарғы жағында - оттегі атомының ядросы, Ядроаралық қашықтық О- 0,1-ге жақын. нм,сутегі атомдарының ядролары арасындағы қашықтық шамамен 0,15 нм. Ал қышқыл атомының сыртқы электронды қабатын құрайтын сегіз электрон lorodaсу молекуласында
Су – реакцияға қабілетті зат. Көптеген металдар мен бейметалдардың оксидтері сумен қосылып, негіздер мен қышқылдар түзеді; кейбір тұздар сумен кристалды гидраттар түзеді; ең белсенді металдар сутегінің бөлінуімен сумен әрекеттеседі.
Судың каталитикалық қасиеті де бар. Ылғалдың іздері болмаған жағдайда, кейбір әдеттегі реакциялар әрең жүреді; мысалы, хлор металдармен әрекеттеспейді, фторид сутегі шыны тоттанбайды, натрий ауада тотықпайды.
Су қалыпты жағдайда газ күйінде болатын бірқатар заттармен қосыла алады, осылайша газ гидраттары деп аталатындарды түзеді. Мысалы, Xe 6H O, CI 8HO, CH 6H O, C H 17H O қосылыстары, олар кристалдар түрінде 0-ден 24 ° C-қа дейінгі температурада (әдетте сәйкес газдың жоғары қысымында) тұнбаға түседі. Мұндай қосылыстар судың құрылымында болатын молекулааралық қуыстарды («қонақ») газ молекулаларымен («қонақ») толтыру нәтижесінде пайда болады. олар инклюзиялық қосылыстар немесе клатраттар деп аталады.
Пуриндік нуклеозидтер:
Пиримидиндік нуклеозидтер:
ФЕРМЕНТТЕР – жасушада синтезделетін және химиялық өзгерістерге ұшырамай, оларда болатын реакцияларды бірнеше рет жеделдететін белокты табиғаттағы органикалық заттар. Осыған ұқсас әсер ететін заттар жансыз табиғатта болады және оларды катализаторлар деп атайды. Ферменттерді (латын тілінен аударғанда fermentum – ашыту, ашыту) кейде ферменттер (грек тілінен аударғанда en – іште, zyme – ашытқы) деп те атайды. Барлық тірі жасушаларда ферменттердің өте үлкен жиынтығы бар, олардың каталитикалық белсенділігі жасушалардың жұмысына байланысты. Жасушада болатын әр түрлі реакциялардың әрқайсысы дерлік белгілі бір ферменттің қатысуын талап етеді. Ферменттердің химиялық қасиеттерін және олар катализдейтін реакцияларды зерттеу биохимияның ерекше, өте маңызды саласы – энзимология.
Көптеген ферменттер цитоплазмада жай еріген күйде жасушада бос күйде болады; басқалары күрделі жоғары ұйымдасқан құрылымдармен байланысты. Қалыпты жағдайда жасушадан тыс болатын ферменттер де бар; осылайша, крахмал мен белоктардың ыдырауын катализдейтін ферменттер ұйқы безі арқылы ішекке бөлінеді. Ферменттерді және көптеген микроорганизмдерді жасырады.
Ферменттер туралы алғашқы мәліметтер ашыту және ас қорыту процестерін зерттеу арқылы алынды. Ашытуды зерттеуге Л.Пастер үлкен үлес қосты, бірақ ол сәйкес реакцияларды тек тірі жасушалар жүргізе алады деп есептеді. 20 ғасырдың басында Э.Бюхнер көмірқышқыл газы мен этил спиртінің түзілуімен сахарозаның ашытуын жасушасыз ашытқы сығындысымен катализдеуге болатынын көрсетті. Бұл маңызды жаңалық жасушалық ферменттерді оқшаулау мен зерттеуді ынталандырды. 1926 жылы Корнелл университетінен (АҚШ) Дж.Сумнер уреазаны бөліп алды; бұл іс жүзінде таза түрде алынған бірінші фермент болды. Содан бері 700-ден астам ферменттер ашылды және бөлініп алынды, бірақ тірі организмдерде одан да көп ферменттер бар. Жеке ферменттердің қасиеттерін анықтау, оқшаулау және зерттеу қазіргі энзимологияда басты орынды алады.
Қанттардың ыдырауы, жоғары энергетикалық қосылыс аденозинтрифосфатының (АТФ) түзілуі және гидролизі сияқты энергияның түрленуінің іргелі процестеріне қатысатын ферменттер жасушалардың барлық түрлерінде - жануарларда, өсімдіктерде, бактерияларда болады. Бірақ белгілі бір ағзалардың ұлпаларында ғана түзілетін ферменттер бар. Осылайша, целлюлоза синтезіне қатысатын ферменттер өсімдік жасушаларында кездеседі, бірақ жануарлар жасушаларында болмайды. Осылайша, «әмбебап» ферменттер мен белгілі бір жасуша түрлеріне тән ферменттерді ажырата білу маңызды. Жалпы айтқанда, жасуша неғұрлым маманданған болса, оның белгілі бір жасушалық функцияны орындау үшін қажетті ферменттер жиынтығын синтездеу ықтималдығы соғұрлым жоғары болады.
Ферменттер белоктар сияқты. Барлық ферменттер қарапайым немесе күрделі белоктар (яғни құрамында белок құрамдас бөлігімен бірге белок емес бөлігі бар). Ақуыздарды да қараңыз.
Ферменттер үлкен молекулалар, олардың молекулалық салмағы 10 000-нан 1 000 000 дальтонға (Да) дейін ауытқиды. Салыстыру үшін айталық. белгілі заттардың массасы: глюкоза – 180, көмірқышқыл газы – 44, амин қышқылдары – 75-тен 204 Да-ға дейін. Бірдей химиялық реакцияларды катализдейтін, бірақ әртүрлі типті жасушалардан оқшауланған ферменттер қасиеттері мен құрамы бойынша ерекшеленеді, бірақ әдетте белгілі бір құрылымдық ұқсастыққа ие.
Ферменттердің жұмыс істеуіне қажетті құрылымдық ерекшеліктері оңай жоғалады. Сонымен, қыздырылған кезде ақуыз тізбегі каталитикалық белсенділіктің жоғалуымен бірге қайта реттеледі. Ерітіндінің сілтілі немесе қышқылдық қасиеттері де маңызды. Көптеген ферменттер Н+ және OH- иондарының концентрациясы шамамен бірдей болғанда, рН 7-ге жақын ерітінділерде жақсы жұмыс істейді. Бұл белок молекулаларының құрылымы, демек, ферменттердің белсенділігі ортадағы сутегі иондарының концентрациясына қатты тәуелді болатындығына байланысты.
Тірі организмдердегі барлық белоктар ферменттер емес. Сонымен, құрылымдық белоктар, көптеген ерекше қан ақуыздары, белок гормондары және т.б басқа қызмет атқарады.
коферменттер мен субстраттар. Көптеген ірі молекулалық салмақты ферменттер кофермент (немесе кофакторлар) деп аталатын арнайы төмен молекулалық салмақты заттардың қатысуымен ғана каталитикалық белсенділікті көрсетеді. Коферменттердің рөлін көптеген витаминдер мен көптеген минералдар атқарады; сондықтан оларды тамақпен бірге қабылдау керек. РР витаминдері (никотин қышқылы немесе ниацин) және рибофлавин, мысалы, дегидрогеназалардың жұмыс істеуі үшін қажетті коферменттердің бөлігі болып табылады. Мырыш – көмірқышқыл газының қаннан бөлінуін катализдейтін фермент, көміртегі ангидразасының коферменті, ол денеден дем шығарылған ауамен бірге шығарылады. Темір мен мыс цитохромоксидаза тыныс алу ферментінің құрамдас бөлігі болып табылады.
Фермент қатысында трансформацияға ұшырайтын зат субстрат деп аталады. Субстрат ферментке қосылады, бұл оның молекуласындағы кейбір химиялық байланыстың үзілуін және басқаларының пайда болуын тездетеді; алынған өнім ферменттен ажырайды. Бұл процесс келесі түрде ұсынылған:
Ферменттердің әсер ету механизмі. Ферментативті реакцияның жылдамдығы субстрат концентрациясына [S] және ферменттің мөлшеріне байланысты. Бұл мәндер ферменттің қанша молекуласының субстратқа қосылатынын анықтайды және осы ферментпен катализденетін реакция жылдамдығы фермент-субстрат кешенінің құрамына байланысты. Биохимиктерді қызықтыратын көптеген жағдайларда фермент концентрациясы өте төмен және субстрат артық болады. Сонымен қатар биохимиктер тұрақты күйге жеткен процестерді зерттейді, онда фермент-субстрат кешенінің түзілуі оның өнімге айналуымен теңестіріледі.
Ферменттердің әсер ету механизмдерін барлық егжей-тегжейлі түсіндіру болашақтың ісі, дегенмен олардың кейбір маңызды ерекшеліктері анықталған. Әрбір ферментте субстрат байланысатын бір немесе бірнеше белсенді учаскелер болады. Бұл орталықтар өте ерекше; тек «олардың» субстратын немесе жақын байланысқан қосылыстарды «тану». Белсенді орталықты фермент молекуласындағы белгілі бір жолмен бір-біріне қатысты бағытталған арнайы химиялық топтар құрайды. Жеңіл болатын ферментативті белсенділіктің жоғалуы дәл осы топтардың өзара бағдарының өзгеруімен байланысты. Ферментпен байланысқан субстрат молекуласы өзгерістерге ұшырайды, соның нәтижесінде кейбір химиялық байланыстар үзіліп, басқа химиялық байланыстар түзіледі. Бұл процестің жүруі үшін энергия қажет; ферменттің рөлі субстрат өнімге айналу үшін еңсеру керек энергетикалық кедергіні төмендету болып табылады. Бұл қысқаруға нақты қалай қол жеткізілгені толық анықталған жоқ.
Ферменттік реакциялар және энергия. Көмірқышқыл газы мен суды түзу үшін алты көміртекті қант глюкозасының тотығуы сияқты қоректік заттар алмасуында энергияның бөлінуі дәйекті үйлестірілген ферментативті реакциялардың нәтижесінде жүреді. Жануарлар жасушаларында глюкозаны пирожүзім қышқылына (пируват) немесе сүт қышқылына (лактат) айналдыруға 10 түрлі фермент қатысады. Бұл процесс гликолиз деп аталады. Бірінші реакция глюкозаның фосфорлануы АТФ қатысуын талап етеді. Әрбір глюкоза молекуласының пирожүзім қышқылының екі молекуласына айналуы екі АТФ молекуласын жұмсайды, бірақ сонымен бірге аралық сатыларда аденозиндифосфаттан (АДФ) 4 АТФ молекуласы түзіледі, осылайша бүкіл процесс 2 АТФ молекуласын береді.
Әрі қарай пирожүзім қышқылы митохондриялармен байланысқан ферменттердің қатысуымен көмірқышқыл газы мен суға дейін тотығады. Бұл түрлендірулер үшкарбон қышқылының циклі немесе лимон қышқылының циклі деп аталатын циклды құрайды. Сондай-ақ МЕТАБОЛИЗМ бөлімін қараңыз.
Бір заттың тотығуы әрқашан екіншісінің тотықсыздануымен байланысты: біріншісі сутегі атомынан бас тартады, ал екіншісі оны қосады. Бұл процестер сутегі атомдарының субстраттардан коферменттерге ауысуын қамтамасыз ететін дегидрогеназалар арқылы катализденеді. Трикарбон қышқылының циклінде кейбір спецификалық дегидрогеназалар коферменттің қалпына келтірілген түрін (никотинамидті динуклеотид, белгіленген NAD) түзу үшін субстраттарды тотықтырады, ал басқалары тотықсызданған коферментті (NADH), басқа тыныс алу ферменттерін, соның ішінде цитохромдарды (құрамында темірі бар гемопроттин) қалпына келтіреді. , онда темір атомы кезектесіп тотығады, содан кейін тотықсызданады. Сайып келгенде, темірі бар негізгі ферменттердің бірі болып табылатын цитохром оксидазасының тотықсызданған түрі біздің денемізге дем алған ауамен енетін оттегі арқылы тотығады. Қантты жанған кезде (атмосфералық оттегімен тотыққан) оның көміртегі атомдары оттегімен тікелей әрекеттесіп, көмірқышқыл газын түзеді. Жанудан айырмашылығы, қант организмде тотыққанда, оттегі цитохромоксидазаның меншікті темірін тотықтырады, бірақ оның тотығу потенциалы, сайып келгенде, көп сатылы, ферменттік процесте қанттарды толық тотықтыру үшін пайдаланылады.
Тотығудың жеке кезеңдерінде қоректік заттардың құрамындағы энергия негізінен шағын бөліктерде бөлінеді және АТФ фосфаттық байланыстарында сақталуы мүмкін. Бұл тотығу реакцияларын (энергия түзетін) ATP түзілу реакцияларымен (энергияны сақтау) байланыстыратын тамаша ферменттерді қамтиды. Бұл қосылу процесі тотығу фосфорлану деп аталады. Егер қосылатын ферментативті реакциялар болмаса, бізге белгілі формалардағы тіршілік мүмкін болмас еді.
Ферменттер басқа да көптеген функцияларды орындайды. Олар тіндік ақуыздардың, майлардың және көмірсулардың түзілуін қоса алғанда, әртүрлі синтез реакцияларын катализдейді. Күрделі организмдерде кездесетін химиялық қосылыстардың кең ауқымын синтездеу үшін бүкіл ферменттік жүйелер қолданылады. Бұл энергияны қажет етеді және барлық жағдайларда ол АТФ сияқты фосфорланған қосылыстардан келеді.
Ферменттер және ас қорыту. Ферменттер ас қорыту процесінің маңызды қатысушылары болып табылады. Тек төмен молекулалық қосылыстар ішек қабырғасынан өтіп, қанға түсе алады, сондықтан тағамдық компоненттер алдымен шағын молекулаларға ыдырауы керек. Бұл белоктардың аминқышқылдарына, крахмалдан қантқа, майлардан май қышқылдарына және глицеринге дейін ферментативті гидролиз (ыдырау) кезінде болады. Белоктардың гидролизі асқазандағы пепсин ферментімен катализденеді. Бірқатар жоғары тиімді ас қорыту ферменттері ұйқы безі арқылы ішекке бөлінеді. Бұл ақуыздарды гидролиздейтін трипсин және химотрипсин; майларды ыдырататын липаза; амилаза крахмалдың ыдырауын катализдейді. Пепсин, трипсин және химотрипсин белсенді емес түрінде, деп аталатын түрінде бөлінеді. зимогендер (проферменттер) және тек асқазан мен ішекте белсенді болады. Бұл ферменттердің ұйқы безі мен асқазанның жасушаларын неліктен жоймайтынын түсіндіреді. Асқазан мен ішектің қабырғалары ас қорыту ферменттерінен және шырыш қабатынан қорғалған. Бірнеше маңызды ас қорыту ферменттері аш ішектің жасушаларында шығарылады.
Шөп немесе шөп сияқты өсімдік тағамдарында жинақталған энергияның көп бөлігі целлюлоза ферменті арқылы ыдырайтын целлюлозада сақталады. Шөпқоректілердің организмінде бұл фермент синтезделмейді, ал ірі қара мен қой сияқты күйіс қайыратын жануарлар целлюлозаны асқазанның бірінші бөлімі – қарыншаны мекендейтін микроорганизмдер түзетіндіктен ғана құрамында целлюлоза бар тағамды жей алады. Термиттер де микроорганизмдердің көмегімен тағамды қорытады.
Ферменттер тамақ, фармацевтика, химия және тоқыма өнеркәсібінде қолданылады. Мысал - папайядан алынған және етті жұмсақ ету үшін қолданылатын өсімдік ферменті. Кір жуғыш ұнтақтарға ферменттер де қосылады.
Медицинадағы және ауыл шаруашылығындағы ферменттер. Барлық жасушалық процестердегі ферменттердің негізгі рөлін білу олардың медицина мен ауыл шаруашылығында кеңінен қолданылуына әкелді. Кез келген өсімдік және жануар организмінің қалыпты жұмыс істеуі ферменттердің тиімді жұмысына байланысты. Көптеген улы заттардың (улардың) әрекеті олардың ферменттерді тежеу қабілетіне негізделген; бірқатар препараттар бірдей әсерге ие. Көбінесе есірткінің немесе улы заттардың әсерін оның жалпы организмдегі немесе белгілі бір тіндегі белгілі бір ферменттің жұмысына таңдамалы әсері арқылы байқауға болады. Мысалы, күшті фосфорорганикалық инсектицидтер және әскери мақсатта жасалған жүйке агенттері ферменттердің жұмысын блоктау арқылы зиянды әсер етеді - ең алдымен жүйке импульстарын беруде маңызды рөл атқаратын холинэстераза.
Дәрілік заттардың ферменттік жүйелерге әсер ету механизмін жақсы түсіну үшін кейбір фермент ингибиторларының қалай жұмыс істейтінін қарастырған жөн. Көптеген ингибиторлар субстрат әрекеттесетін ферменттің белсенді аймағымен байланысады. Мұндай ингибиторларда ең маңызды құрылымдық белгілері субстраттың құрылымдық ерекшеліктеріне жақын, ал егер реакциялық ортада субстрат та, ингибитор да болса, олар ферментпен байланысу үшін бәсекеге түседі; субстрат концентрациясы неғұрлым жоғары болса, ол ингибитормен соғұрлым табысты бәсекелеседі. Басқа түрдегі ингибиторлар функционалды маңызды химиялық топтарды қамтитын фермент молекуласында конформациялық өзгерістерді тудырады. Ингибиторлардың әсер ету механизмін зерттеу химиктерге жаңа препараттарды жасауға көмектеседі.
Гликолиз.
Гликолиз – тірі ағзалардың биоэнергетикалық қажеттіліктерін қанағаттандыру үшін глюкозаны және басқа көмірсуларды пайдалану жолындағы бірінші және анаэробты жағдайда негізгі кезең. Сонымен қатар, гликолиздің аралық кезеңдерінде үш көміртекті фрагменттер түзіледі, олар бірқатар заттардың биосинтезі үшін қолданылады.
Гликолиздің негізгі сатысы тотықтырғыш ретінде екі NAD молекуласын қолдана отырып, глюкозаның пируваттың екі молекуласына, пирожүзім қышқылының тұзына дейін тотығу ыдырауы болып табылады. Процестің стереометриялық теңдеуі былай жазылады:
1. Глюкозаның гексокиназа арқылы катализделген глюкоза-6-фосфатқа айналуы:
2. Глюкоза-6-фосфаттың глюкоза-6-фосфат изомеразасымен катализделген фруктоза-6-фосфатқа изомерленуі:
3. Фруктоза-b-фосфаттың фруктоза-1,6-дифосфатқа дейін фосфорлануы, 6-фосфофруктогназамен катализденеді:
4. Фруктоза-1,6-дпфосфаттың глзралдегпд-3-фосфатқа және фруктозамен және фосфатпен альдолазамен катализделген дигидроксиацетонфосфатқа ыдырауы:
5. Триозафосфат изомеразамен катализделген дигидроксиацетонфосфаттың глицеральдегид-3-фосфатқа изомерленуі:
Егер келесі қадамдар глюкозаның конверсиясының басым бағыты болса, онда бұл реакция дигидроксцетонфосфаттың глицеральдегид-3-фосфатқа дейін біртіндеп тоқтатылуын қамтамасыз етеді.
6. Глицеральдегид-3-фосфаттың глицеральдегид-3-фосфатдегидрозиеназамен катализделген 1,3-дифосфаглицератқа дейін тотығуы:
Процесс ферменттің активті орталығына баратын тотығатын альдегид тобы мен Знтеппа қалдығының Sll-тобы арасында триэфирдің аралық түзілуі арқылы жүреді. Содан кейін бұл байланыс бейорганикалық фосфатпен фосфорлизге ұшырайды, белсенді аймақ регенерацияланады және 3-фосфоглицерин қышқылы мен фосфор қышқылының аралас ангидриді түзіледі:
7. Фосфоглицераткиназамен катализденген АТФ молекуласының түзілуімен фосфаттың 1,3-дфосфоглицераттан АДФ-ке ауысуы (атауы кері реакцияға сәйкес берілген):
8. 3-фосфоглицераттың фосфоглицерат мутазасымен катализделген 2-фосфоглицератқа изомерленуі:
9. Эуолаза n катализдейтін 2-фосфоглицераттың сусыздануы, күшті макроэрг – фосфоэиолпроват түзілуіне әкеледі:
10. Фосфаттың фосфоэнол пируваттан АДФ-ке ауысуы, пируаткиназа катализденетін басқа АТФ молекуласының түзілуі (атауы кері реакцияға сәйкес берілген):
Бұл теңдеулерді қорытындыламас бұрын, гликолиздің алғашқы кезеңдерінде глюкозаны глюкоза-6-фосфатқа және фруктоза-6-фосфатқа айналдыру үшін A-GP молекулаларындағы екі жоғары энергетикалық байланыс жұмсалатынына назар аудару керек. фруктоза-1,6-дифосфат Келесі сатыларда глюкозаның бір бастапқы молекуласына екі АДФ молекуласы реакцияда және екеуі реакцияда фосфорланады. Осылайша, нәтиже екі АДФ молекуласы мен екі ортофосфат молекуласының екі ATP молекуласына айналуы болып табылады. .Осыны ескере отырып, жалпы теңдеуді былай жазу керек:
Егер глюкоза-6-фосфаттан санасақ, онда теңдеу келесі түрде болады:
Гликолиз схемасы (глюкозаның пируваттың екі молекуласына айналуы)
табиғи және денатуратталған белоктар.
Тірі организмдердегі белоктар мен нуклеин қышқылдары полимер тізбегінің мономер бірліктері арқылы бірізді ұзаруы арқылы түзіледі, олардың қосылу реті биосинтезді бағдарламалайтын нуклеин қышқылдарымен анықталады. Алайда, соңғысының өзі құрылған биополимердің бастапқы құрылымын ғана анықтайды. Биополимер өзінің жұмыс істеуі үшін қажетті табиғи құрылымды қабылдауы үшін соңғысы ақуыздың ең бастапқы құрылымымен бағдарламалануы керек.
Ақуыздың нативтілігі үштік құрылымымен анықталады. Нақты протеин - бұл барлық биологиялық функцияларды орындауға қабілетті ақуыз. Тритикалық құрылым ортаның рН өзгеруіне, температураның өзгеруіне, ауыр металдардың тұздарына және т.б. әсерінен оңай бұзылады. Ақуыз температура көтерілген сайын өзінің қасиеттерін жоғалтады және табиғи құрылымның термодинамикалық тұрақсыз болатын кезі сөзсіз келеді. Оның бұзылуы полипептидтік тізбектің реттелген растауды жоғалтуына және үздіксіз өзгеретін кеңістіктік құрылымы бар полимерге айналуына әкеледі. Макромолекулалық қосылыстардың химиясында мұндай түзілістерді статистикалық катушкалар деп атайды. Биохимияда нативті ақуыздың кездейсоқ катушкаға айналуын белок денатурациясы деп атайды.
Денатуратталған ақуыз кез келген биологиялық белсенділіктен айырылған, ал биологиялық жүйелерде ол негізінен аминқышқылдарының көзі ретінде ғана пайдаланылуы мүмкін, т.б. тағамдық зат ретінде.
Денатуратталған ақуыздың нативтіге кері айналуы нативті құрылым бастапқы құрылымда бағдарламаланғанда ғана мүмкін болады.
витаминдертоптарD.
Құрылымы бойынша аздап ерекшеленетін он шақты D витамині белгілі. Олардың барлығы стероидтар тобына жатады – конденсацияланған сақиналары бар күрделі органикалық қосылыстар. Барлық D дәрумендері өсіп келе жатқан адам сүйектерінде кальций мен фосфордың шөгуін басқаруға қатысады. Д витамині болмаған кезде бұл процесс бұзылып, сүйектер жұмсақ және деформацияланады. Бұл құбылыс рахит деп аталады және тек балалық шаққа тән.
D дәрумені кейбір тағамдарда кездеседі, бірақ адамның өсуіне жеткіліксіз мөлшерде. Ағзада D дәрумендерінің жетіспейтін мөлшерін 7-дегидро-холестериннің болуына байланысты өтейді - құрылымы бойынша D дәруменіне ұқсас стероидтер тобынан қосылыс. 7-дегидрохолестерин тікелей терінің астында болады. Күн сәулесінің әсерінен адам D3 витаминіне айналады:
D дәрумені (кальциферол) құрылымы бойынша D3 витаминіне өте ұқсас және стероидты спирттен – эргостеролдан, ашытқыда, зеңде және т.б. құрамында сәулелену әсерінен түзіледі.
Пептидтің құрылымдық формуласы - валил-изолейцил-метионил-аргенин.
Библиография
1. Д.Э., Техника және өндіріс. М., 1972 ж
2. Хомченко Г.П. , Жоғары оқу орнына түсушілерге арналған химия. М., 1995 ж
3. Прокофьев М.А., Жас химиктің энциклопедиялық сөздігі. М., 1982 ж
4. Глинка Н.Л., Жалпы химия. Ленинград, 1984 ж
5. Н.С.Ахметов, Бейорганикалық химия. Мәскеу, 1992 ж





