natívny proteín. Koncept natívneho proteínu. Koncept alosterických proteínov. Teoretické základy lekcie
Peptidová väzba určuje kostru (chrbticu) primárnej štruktúry molekuly proteínu a dodáva jej tuhosť.
Teoretický základ triedy
Štruktúra molekuly proteínu
Účel lekcie:študovať typy makromolekulárnej organizácie molekúl bielkovín.
Primárna štruktúra proteínov- poradie aminokyselín v polypeptidovom reťazci (alebo reťazcoch) a poloha disulfidových väzieb (ak existujú).
Primárna štruktúra je stabilizovaná kovalentnými väzbami: peptidovými väzbami a v niektorých peptidoch disulfidovými väzbami.
Deštrukcia kovalentných väzieb primárnej štruktúry - hydrolýza: 1) kyslá - v 6 n. HCl, 100-110 °C, 24 hodín; 2) enzymatické - s pomocou proteolytických enzýmov v žalúdku pri pH 1,5-5,0 - pepsín; trypsín, chymotrypsín, karboxypeptidáza - v dvanástniku; dipeptidázy, tripeptidázy a aminopeptidázy – v tenkom čreve, pri pH 8,6.
Charakterizácia peptidovej väzby. Peptidová väzba je rovinná (koplanárna). C-N spojenie pripomína dvojitú väzbu (rotácia je nemožná) v dôsledku p, π - konjugácia (konjugácia voľného páru elektrónov atómu s π-elektrónmi dvojitej väzby C=O).
Poradie aminokyselín v primárnej štruktúre proteínu je špecifické druhy charakteristické pre tento proteín.
Primárna štruktúra proteínu geneticky určené a reprodukované v procesoch transkripcie a translácie.
Primárna štruktúra proteínu je základ pre tvorbu následných proteínových štruktúr v dôsledku interakcie radikálov aminokyselinových zvyškov polypeptidového reťazca.
Nahradenie aminokyseliny L-série aminokyselinou D-série alebo nahradenie čo i len jednej L-aminokyseliny inou môže viesť k úplnému vymiznutiu biologická aktivita peptid.
Fyziologicky aktívne peptidy obsahujú od 3 do 100 aminokyselinových zvyškov (MM pod 6000 Da). Na rozdiel od proteínov môžu polypeptidy obsahovať neproteinogénne alebo modifikované proteinogénne aminokyseliny. Príklady:
1. Bradykinín a kalidín spôsobujú relaxáciu hladkého svalstva a sú produktom proteolýzy špecifických plazmatických a 2-globulínov, preto tieto peptidy obsahujú iba proteinogénne aminokyseliny:
bradykinín: arg-pro-pro-gly-fen-ser-pro-fen-arg;
Kallidin: Lys-arg-pro-pro-gli-phen-ser-pro-phen-arg.
2. Glutatión (γ-glu-cis-gli) sa nachádza vo všetkých bunkách. Je nevyhnutný pre transport aminokyselín cez membrány, pre prácu množstva enzýmov. Zachováva disulfidové väzby, obsahuje atypickú peptidovú väzbu, keď glutamát nie je viazaný na cysteín cez a-aminoskupinu.
Polymorfizmus proteínov- ide o existenciu toho istého proteínu v niekoľkých molekulárnych formách, ktoré sa líšia primárnou štruktúrou, fyzikálno-chemickými vlastnosťami a prejavmi biologickej aktivity.
Príčinou proteínového polymorfizmu sú rekombinácie a mutácie génov. Izoproteíny sú viacnásobné molekulárne formy proteínu, ktoré sa nachádzajú v organizmoch rovnakého druhu v dôsledku prítomnosti viac ako jedného štruktúrneho génu v druhovom genofonde. Viaceré gény môžu byť reprezentované ako viaceré alely alebo ako viaceré génové lokusy.
Príklady proteínového polymorfizmu.
1. Polymorfizmus proteínov vo fylogenéze – existencia homológnych proteínov u rôznych druhov. V týchto proteínoch zostávajú oblasti primárnej štruktúry zodpovedné za ich funkciu konzervatívne (nezmenené). Na nahradenie stratených bielkovín v ľudskom tele sa používajú homológne živočíšne bielkoviny, v primárnej štruktúre ktorých sú minimálne rozdiely (hovädzí, prasací, veľrybí inzulín).
2. Polymorfizmus proteínov v ontogenéze - existencia homológnych proteínov v rôznych segmentoch životného cyklu organizmu. Plod má hemoglobín F (fetálny hemoglobín, α 2 γ 2, má vysokú afinitu ku kyslíku). Po narodení je nahradený hemoglobínom A 1 (a 2 b 2).
3. Polymorfizmus tkanivového proteínu. Ten istý enzým v rôznych bunkách katalyzuje rovnakú reakciu, má však rozdiely v primárnej štruktúre – izoenzýmy. Stanovenie izoenzýmov v krvi pomáha diagnostikovať poškodenie konkrétneho tkaniva.
4. Polymorfizmus proteínov v patológii. Zoberme si príklad viacerých foriem mutácií, ktoré sú zdedené. V tomto prípade najčastejšie dochádza k nahradeniu kyslej aminokyseliny zásaditou alebo neutrálnou:
v HbC nahradenie glu 6 v p-reťazci lýzou;
v HbE nahradenie glu 26 v p-reťazci lys;
v HbI nahradenie lys 16 v p-reťazci asp;
v HbS nahradenie glu 6 v β-reťazci hriadeľom.
V druhom prípade sa vyskytuje ochorenie, ako je kosáčikovitá anémia. Anomálne hemoglobíny sa líšia od normálnych vo svojom náboji a elektroforetickej pohyblivosti. Fyzikálno-chemické zmeny hemoglobínov sú sprevádzané porušením transportu kyslíka.
Sekundárna štruktúra proteínu- pravidelná organizácia polypeptidového reťazca, stabilizovaná vodíkovými väzbami. Medzi skupinami NH a CO peptidových väzieb vznikajú vodíkové väzby. Existuje a-helix, b-štruktúra a neusporiadaná konformácia (cievka).
a-Špirála. Krútenie polypeptidového reťazca je v smere hodinových ručičiek (pravá špirála), čo je spôsobené štruktúrou L-aminokyselín. Na každý obrat (krok) špirály pripadá 3,6 aminokyselinových zvyškov. Stúpanie špirály je 0,54 nm, s 0,15 nm na aminokyselinový zvyšok. Uhol skrutkovice je 26°. každých 5 závitov špirály (18 aminokyselinových zvyškov) sa štruktúra polypeptidového reťazca opakuje. Vodíkové väzby sú rovnobežné s osou špirály a vyskytujú sa medzi každým prvým a každým piatym aminokyselinovým zvyškom. Tvorbe a-helixu bránia prolín a aminokyseliny s objemnými a nabitými radikálmi.
Β-Štruktúra. Vo fibrilárnych proteínoch sú dva alebo viac lineárnych polypeptidových reťazcov pevne viazané vodíkovými väzbami kolmo na os molekuly (zložená b-vrstva). Ak sú dva polypeptidové reťazce spojené medzireťazcovými vodíkovými väzbami, idúcimi rovnakým smerom od N- po C-koniec, potom ide o paralelnú β-štruktúru. Ak sú N- a C-konce reťazcov opačné, potom ide o antiparalelnú b-štruktúru. Ak sa jeden polypeptidový reťazec ohýba a prebieha paralelne so sebou, ide o antiparalelnú β-krížovú štruktúru. Miesta ohybu reťaze sú určené pro, gli, asn-b-bend.
neusporiadaná konformácia. Úseky molekuly proteínu, ktoré nepatria do špirálových alebo zložených štruktúr, sa nazývajú neusporiadané. V grafickom znázornení sú špirálové rezy znázornené ako valec a zložené štruktúry sú znázornené šípkou. Rozlišuje sa pojem suprasekundárna štruktúra, čo je pravidelné striedanie a-helikálnych sekcií a b-štruktúr.
Terciárna štruktúra- konformácia polypeptidového reťazca ako celku (t.j. umiestnenie v trojrozmernom priestore). Terciárna štruktúra je stabilizovaná väzbami a interakciami medzi radikálmi aminokyselinových zvyškov polypeptidového reťazca: kovalentná - disulfidová väzba, ako aj vodík, iónové väzby a hydrofóbna interakcia. Typy proteínov s terciárnou štruktúrou:
proteíny, v ktorých prevládajú a-helikálne úseky, majú tvar globule (globulárne proteíny) a vykonávajú dynamické funkcie;
proteíny, ktorým dominujú štruktúry zloženej b-vrstvy, majú filamentózny (fibrilárne proteíny) tvar a vykonávajú štrukturálne funkcie;
Kolagén je najbežnejšou bielkovinou v živočíšnom svete (až 25% všetkých telesných bielkovín), má špeciálnu štruktúru. Molekula kolagénu (tropokolagén) sa skladá z troch polypeptidových reťazcov. Každý polypeptidový reťazec obsahuje približne 1000 aminokyselinových zvyškov (35 % glycínu, 21 % prolínu a hydroxyprolínu, 11 % alanínu). Každý polypeptidový reťazec má pevnú helixovú konformáciu (3 aminokyselinové zvyšky na otáčku). V molekule tropokolagénu sú všetky tri helixy navzájom prepletené a vytvárajú turniket. Vodíkové väzby sa vytvárajú medzi špirálami vďaka peptidovým skupinám. Táto štruktúra zabezpečuje pevnosť kolagénových vlákien.
Štruktúra prirodzeného proteínu.
Mnohé proteíny v terciárnej štruktúre majú špirálovité, zložené a neusporiadané segmenty. Zároveň je z funkčného a štrukturálneho hľadiska dôležité vzájomné usporiadanie aminokyselinových radikálov. Spotrebovať nasledujúce podmienky:
domén – anatomicky odlíšené oblasti terciárnej štruktúry proteínu, zodpovedné za vykonávanie špecifickej funkcie proteínu;
hydrofóbne vrecká – dutiny v terciárnej štruktúre vystlané hydrofóbnymi aminokyselinovými radikálmi; slúžia na ponorenie hydrofóbnych ligandov do molekuly proteínu;
hydrofóbne zhluky – oblasti proteínového povrchu, kde sú koncentrované radikály hydrofóbnych aminokyselín; slúžia na interakciu s hydrofóbnymi zhlukmi iných molekúl.
Aby mohol proteín vykonávať funkciu, musí mať špecifickú a často jedinú terciárnu štruktúru (konformáciu) – natívnu štruktúru.
Ryža. 3.9. Terciárna štruktúra laktoglobulínu, typický a/p proteín (podľa PDB-200I) (Brownlow, S., Marais Cabral, J. H., Cooper, R., Flower, D. R., Yewdall, S. J., Polikarpov, I., North, A. C. , Sawyer, L.: Štruktúra, 5, s. 481. 1997)
Priestorová štruktúra nezávisí od dĺžky polypeptidového reťazca, ale od sekvencie aminokyselinových zvyškov špecifických pre každý proteín, ako aj od vedľajších radikálov charakteristických pre zodpovedajúce aminokyseliny. Priestorová trojrozmerná štruktúra alebo konformácia proteínových makromolekúl je primárne tvorená vodíkovými väzbami, ako aj hydrofóbnymi interakciami medzi nepolárnymi bočnými radikálmi aminokyselín. Hrajú sa vodíkové väzby obrovskú úlohu pri tvorbe a udržiavaní priestorovej štruktúry makromolekuly proteínu. Vodíková väzba sa vytvára medzi dvoma elektronegatívnymi atómami pomocou protónu vodíka kovalentne viazaného na jeden z týchto atómov. Keď sa jediný elektrón atómu vodíka podieľa na tvorbe elektrónového páru, protón je priťahovaný k susednému atómu a vytvára vodíkovú väzbu. Predpokladom pre vznik vodíkovej väzby je prítomnosť aspoň jedného voľného elektrónového páru na elektronegatívnom atóme. Čo sa týka hydrofóbnych interakcií, vznikajú v dôsledku kontaktu medzi nepolárnymi radikálmi, ktoré nie sú schopné rozbiť vodíkové väzby medzi molekulami vody, ktorá je vytesnená na povrch proteínovej globule. Keď sa proteín syntetizuje, nepolárne chemické skupiny sa zhromažďujú vo vnútri globule a polárne skupiny sú vytlačené na jej povrch. teda molekula proteínu môže byť neutrálny, kladne nabitý alebo záporne nabitý, v závislosti od pH rozpúšťadla a iónových skupín v proteíne. Medzi slabé interakcie patria aj iónové väzby a van der Waalsove interakcie. Okrem toho je proteínová konformácia udržiavaná S-S kovalentnými väzbami vytvorenými medzi dvoma cysteínovými zvyškami. V dôsledku hydrofóbnych a hydrofilných interakcií molekula proteínu spontánne preberá jednu alebo viacero termodynamicky najpriaznivejších konformácií a ak je prirodzená konformácia narušená v dôsledku akýchkoľvek vonkajších vplyvov, je možná jej úplná alebo takmer úplná obnova. Prvýkrát to ukázal K. Anfinsen s použitím katalyticky aktívneho proteínu ribonukleázy ako príkladu. Ukázalo sa, že pri pôsobení močoviny alebo p-merkaptoetanolu sa mení jeho konformácia a v dôsledku toho dochádza k prudkému poklesu katalytickej aktivity. Odstránenie močoviny vedie k prechodu konformácie proteínu do pôvodného stavu a katalytická aktivita sa obnoví.
Konformácia proteínov je teda trojrozmerná štruktúra a v dôsledku jej tvorby sa mnohé atómy nachádzajúce sa vo vzdialených častiach polypeptidového reťazca navzájom približujú a navzájom na seba pôsobiace získavajú nové vlastnosti, ktoré v jednotlivých aminoskupinách chýbajú. kyseliny alebo malé polypeptidy. Tento tzv terciárna štruktúra, charakterizované orientáciou polypeptidových reťazcov v priestore (obr. 3.9). Terciárna štruktúra globulárnych a fibrilárnych proteínov sa navzájom výrazne líši. Je obvyklé charakterizovať formu proteínovej molekuly takým indikátorom, ako je stupeň asymetrie (pomer dlhej osi molekuly ku krátkej). V globulárnych proteínoch je stupeň asymetrie 3-5, ako u fibrilárnych proteínov je táto hodnota oveľa vyššia (od 80 do 150).
Ako sa teda primárne a sekundárne rozvinuté štruktúry premenia na zloženú, vysoko stabilnú formu? Výpočty ukazujú, že počet teoreticky možných kombinácií na vytvorenie trojrozmerných štruktúr proteínov je nemerateľne väčší ako tie, ktoré skutočne existujú v prírode. Energeticky najpriaznivejšie formy sú zjavne hlavným faktorom konformačnej stability.
Hypotéza o roztavenej globule. Jedným zo spôsobov, ako študovať skladanie polypeptidového reťazca do trojrozmernej štruktúry, je denaturácia a následná resaturácia molekuly proteínu.
Experimenty K. Anfinsena s ribonukleázou jasne ukazujú možnosť zostaviť presne tú priestorovú štruktúru, ktorá bola narušená v dôsledku denaturácie (obr. 3.10).
V tomto prípade obnovenie pôvodnej konformácie nevyžaduje žiadnu doplnkové štruktúry. Aké modely skladania polypeptidového reťazca do zodpovedajúcej konformácie sú najpravdepodobnejšie? Jednou z rozšírených hypotéz samoorganizácie proteínov je hypotéza o roztavenej globule. V rámci tohto konceptu sa rozlišuje niekoľko stupňov samozostavovania proteínov.
- 1. V rozvinutom polypeptidovom reťazci sa pomocou vodíkových väzieb a hydrofóbnych interakcií vytvárajú samostatné úseky sekundárnej štruktúry, slúžiace ako zárodok pre tvorbu úplných sekundárnych a supersekundárnych štruktúr.
- 2. Keď počet týchto miest dosiahne určitú prahovú hodnotu, bočné radikály sa preorientujú a polypeptidový reťazec prechádza do novej kompaktnejšej formy a počet nekovalentných väzieb

Ryža. 3.10.
výrazne zvyšuje. Charakteristickým znakom tohto štádia je vytvorenie špecifických kontaktov medzi atómami umiestnenými na vzdialených miestach polypeptidového reťazca, ktoré sa však v dôsledku vytvorenia terciárnej štruktúry ukázali byť blízke.
3. V poslednom štádiu sa vytvorí natívna konformácia molekuly proteínu spojená s uzavretím disulfidových väzieb a konečnou stabilizáciou konformácie proteínu. Nie je vylúčená ani nešpecifická agregácia.
polyptidové reťazce, ktoré možno kvalifikovať ako chyby pri tvorbe natívnych proteínov. Čiastočne poskladaný polypeptidový reťazec (krok 2) sa nazýva roztavená globula a štádium 3 je najpomalší pri tvorbe zrelého proteínu.
Na obr. 3.11 ukazuje variant tvorby proteínovej makromolekuly kódovanej jedným génom. Je však známe, že množstvo proteínov má doménu

Ryža. 3.11.
(podľa N.K. Nagradova) nuyu štruktúra, vzniká v dôsledku duplikácie génov a vytvorenie kontaktov medzi jednotlivými doménami si vyžaduje dodatočné úsilie. Ukázalo sa, že bunky majú špeciálne mechanizmy na reguláciu skladania novosyntetizovaných proteínov. V súčasnosti boli identifikované dva enzýmy zapojené do implementácie týchto mechanizmov. Jednou z pomalých reakcií tretieho štádia skladania polypeptidových reťazcov je * 
Ryža. 3.12.
Okrem toho bunky obsahujú množstvo katalyticky neaktívnych proteínov, ktoré však výrazne prispievajú k tvorbe priestorových proteínových štruktúr. Ide o takzvané chaperóny a chaperoníny (obr. 3.12). Jeden z objaviteľov molekulárnych chaperónov L. Ellis ich nazýva funkčnou triedou navzájom nesúvisiacich proteínových rodín, ktoré napomáhajú správnemu nekovalentnému zostaveniu iných štruktúr obsahujúcich polypeptidy in vivo, ale nie sú súčasťou tzv. zostavené štruktúry a nezúčastňujú sa na realizácii ich normálnych fyziologických funkcií.
Chaperóny pomáhajú pri správnom zostavovaní trojrozmernej proteínovej konformácie vytváraním reverzibilných, nekovalentných komplexov s čiastočne poskladaným polypeptidovým reťazcom, pričom inhibujú chybne vytvorené väzby vedúce k tvorbe funkčne neaktívnych proteínových štruktúr. Zoznam funkcií, ktoré sú súčasťou chaperónov, zahŕňa ochranu roztavených guľôčok pred agregáciou, ako aj prenos novosyntetizovaných proteínov do rôznych bunkových lokusov. Chaperóny sú prevažne proteíny tepelného šoku, ktorých syntéza sa prudko zvyšuje pri stresovej teplote, preto sa nazývajú aj hsp (proteíny tepelného šoku). Rodiny týchto proteínov sa nachádzajú v mikrobiálnych, rastlinných a živočíšnych bunkách. Klasifikácia chaperónov je založená na ich molekulovej hmotnosti, ktorá sa pohybuje od 10 do 90 kDa. Vo všeobecnosti sa funkcie chaperónov a chaperonínov líšia, hoci obe sú pomocnými proteínmi v procesoch tvorby trojrozmernej štruktúry proteínov. Chaperóny udržujú novosyntetizovaný polypeptidový reťazec v nezvinutom stave, čím bránia jeho zvinutiu do formy odlišnej od natívnej a chaperoníny poskytujú podmienky na vytvorenie jedinej správnej, natívnej proteínovej štruktúry (obr. 3.13).

Ryža. 3.13.
Chaperóny / sú spojené s nanscentným polypeptidovým reťazcom zostupujúcim z ribozómu. Po vytvorení polypeptidového reťazca a jeho uvoľnení z ribozómu sa naň naviažu chaperóny a zabránia agregácii. 2. Po poskladaní v cytoplazme sa proteíny oddelia od chaperónu a prenesú sa na príslušný chaperonín, kde nastáva konečná tvorba terciárnej štruktúry. 3. Pomocou cytosolického chaperónu sa proteíny presúvajú na vonkajšiu membránu mitochondrií, kde ich mitochondriálny chaperón vtiahne do mitochondrií a „prenesie“ do mitochondriálneho chaperonínu, kde dochádza k zloženiu. 4, a 5 je podobný 4 , ale vo vzťahu k endoplazmatickému retikulu.
MODUL 1 ŠTRUKTÚRA, VLASTNOSTI A FUNKCIE PROTEÍNOV
MODUL 1 ŠTRUKTÚRA, VLASTNOSTI A FUNKCIE PROTEÍNOV
Štruktúra modulu | Témy |
Modulárna jednotka 1 | 1.1. Štrukturálna organizácia proteínov. Etapy tvorby natívnej konformácie proteínov 1.2. Základy fungovania bielkovín. Lieky ako ligandy ovplyvňujúce funkciu proteínov 1.3. Denaturácia bielkovín a možnosť ich spontánnej renativácie |
Modulárna jednotka 2 | 1.4. Vlastnosti štruktúry a fungovania oligomérnych proteínov na príklade hemoglobínu 1.5. Udržiavanie prirodzenej konformácie proteínov v bunke 1.6. Rozmanitosť bielkovín. Proteínové rodiny na príklade imunoglobulínov 1.7. Fyzikálno-chemické vlastnosti bielkovín a metódy ich separácie |
Modulárna jednotka 1 ŠTRUKTURÁLNA ORGANIZÁCIA MONOMERICKÝCH PROTEÍNOV A ZÁKLAD ICH FUNGOVANIA
Ciele vzdelávania Byť schopný:
1. Využiť poznatky o štruktúrnych znakoch proteínov a závislosti funkcií proteínov od ich štruktúry na pochopenie mechanizmov vzniku dedičných a získaných proteinopatií.
2. Vysvetlite mechanizmy terapeutického účinku niektorých liečiv ako ligandov, ktoré interagujú s proteínmi a menia ich aktivitu.
3. Využiť poznatky o štruktúre a konformačnej labilite proteínov na pochopenie ich štruktúrnej a funkčnej nestability a sklonu k denaturácii v meniacich sa podmienkach.
4. Vysvetlite použitie denaturačných činidiel ako prostriedkov na sterilizáciu medicínskeho materiálu a nástrojov, ako aj antiseptík.
Vedieť:
1. Úrovne štruktúrna organizácia bielkoviny.
2. Význam primárnej štruktúry bielkovín, ktorá určuje ich štruktúrnu a funkčnú diverzitu.
3. Mechanizmus vzniku aktívneho centra v proteínoch a jeho špecifická interakcia s ligandom, ktorý je základom fungovania proteínov.
4. Príklady vplyvu exogénnych ligandov (lieky, toxíny, jedy) na konformáciu a funkčnú aktivitu proteínov.
5. Príčiny a účinky denaturácie bielkovín, faktory spôsobujúce denaturáciu.
6. Príklady použitia denaturačných faktorov v medicíne ako antiseptík a prostriedkov na sterilizáciu lekárskych nástrojov.
TÉMA 1.1. ŠTRUKTURÁLNA ORGANIZÁCIA PROTEÍNOV. ETAPY TVORENIA RODÁKA
PROTEÍNOVÉ KONFORMÁCIE
Proteíny sú polymérne molekuly, ktorých monoméry tvoria iba 20 α-aminokyselín. Súbor a poradie spojenia aminokyselín v proteíne je určené štruktúrou génov v DNA jednotlivcov. Každý proteín v súlade so svojou špecifickou štruktúrou plní svoju vlastnú funkciu. Súbor proteínov daného organizmu určuje jeho fenotypové znaky, ako aj prítomnosť dedičných chorôb alebo predispozíciu k ich rozvoju.
1. Aminokyseliny, ktoré tvoria bielkoviny. peptidová väzba. Proteíny sú polyméry postavené z monomérov - 20 α-aminokyselín, ktorých všeobecný vzorec je
Aminokyseliny sa líšia štruktúrou, veľkosťou, fyzikálno-chemickými vlastnosťami radikálov pripojených k atómu uhlíka α. Funkčné skupiny aminokyselín určujú vlastnosti rôznych α-aminokyselín. Radikály nachádzajúce sa v α-aminokyselinách možno rozdeliť do niekoľkých skupín:
prolín, na rozdiel od ostatných 19 proteínových monomérov, nie aminokyseliny, ale iminokyseliny, je radikál v prolíne spojený s atómom α-uhlíka aj s iminoskupinou.
 Aminokyseliny sa líšia svojou rozpustnosťou vo vode. Je to spôsobené schopnosťou radikálov interagovať s vodou (aby bola hydratovaná).
Aminokyseliny sa líšia svojou rozpustnosťou vo vode. Je to spôsobené schopnosťou radikálov interagovať s vodou (aby bola hydratovaná).
TO hydrofilné zahŕňajú radikály obsahujúce aniónové, katiónové a polárne nenabité funkčné skupiny.
TO hydrofóbne Zahrňujú radikály obsahujúce metylové skupiny, alifatické reťazce alebo cykly.
2. Peptidové väzby spájajú aminokyseliny do peptidov. Počas syntézy peptidu α-karboxylová skupina jednej aminokyseliny interaguje s α-aminoskupinou inej aminokyseliny za vzniku peptidová väzba:
Proteíny sú polypeptidy, t.j. lineárne polyméry a-aminokyselín spojené peptidová väzba(Obr. 1.1.)
 Ryža. 1.1. Termíny používané pri opise štruktúry peptidov
Ryža. 1.1. Termíny používané pri opise štruktúry peptidov
Aminokyselinové monoméry, ktoré tvoria polypeptidy, sa nazývajú aminokyselinové zvyšky. Reťaz opakujúcich sa skupín - NH-CH-CO- formuláre peptidová kostra. Aminokyselinový zvyšok s voľnou a-aminoskupinou sa nazýva N-koncový a zvyšok s voľnou a-karboxylovou skupinou sa nazýva C-koncový. Peptidy sa zapisujú a čítajú od N-konca po C-koniec.
Peptidová väzba tvorená iminoskupinou prolínu sa líši od iných peptidových väzieb: atóm dusíka peptidovej skupiny nemá vodík,
namiesto toho existuje väzba s radikálom, v dôsledku čoho je jedna strana cyklu zahrnutá do peptidovej kostry:
 Peptidy sa líšia zložením aminokyselín, počtom aminokyselín a poradím aminokyselín, napríklad Ser-Ala-Glu-Gis a His-Glu-Ala-Ser sú dva rôzne peptidy.
Peptidy sa líšia zložením aminokyselín, počtom aminokyselín a poradím aminokyselín, napríklad Ser-Ala-Glu-Gis a His-Glu-Ala-Ser sú dva rôzne peptidy.
Peptidové väzby sú veľmi silné a na ich chemickú neenzymatickú hydrolýzu sú potrebné drsné podmienky: analyzovaný proteín sa hydrolyzuje v koncentrovanej kyseline chlorovodíkovej pri teplote asi 110 °C počas 24 hodín. V živej bunke môžu byť peptidové väzby prerušené proteolytické enzýmy, volal proteázy alebo peptidové hydrolázy.
3. Primárna štruktúra bielkovín. Aminokyselinové zvyšky v peptidových reťazcoch rôznych proteínov sa nestriedajú náhodne, ale sú usporiadané v určitom poradí. Lineárna sekvencia alebo sekvencia aminokyselinových zvyškov v polypeptidovom reťazci sa nazýva primárna štruktúra proteínu.
Primárna štruktúra každého jednotlivého proteínu je zakódovaná v molekule DNA (v oblasti nazývanej gén) a realizuje sa pri transkripcii (prepisovanie informácie o mRNA) a translácii (syntéze primárnej štruktúry proteínu). Primárna štruktúra proteínov jednotlivca je teda informácia zdedená z rodičov na deti, ktorá určuje štrukturálne znaky proteínov daného organizmu, od ktorých závisí funkcia existujúcich proteínov (obr. 1.2.).
 Ryža. 1.2. Vzťah medzi genotypom a konformáciou proteínov syntetizovaných v tele jedinca
Ryža. 1.2. Vzťah medzi genotypom a konformáciou proteínov syntetizovaných v tele jedinca
Každý z približne 100 000 jednotlivých proteínov v ľudskom tele má jedinečný primárna štruktúra. Molekuly jedného typu proteínu (napríklad albumínu) majú rovnaké striedanie aminokyselinových zvyškov, čo odlišuje albumín od akéhokoľvek iného jednotlivého proteínu.
Sekvenciu aminokyselinových zvyškov v peptidovom reťazci možno považovať za formu záznamu informácie. Táto informácia určuje priestorové skladanie lineárneho peptidového reťazca do kompaktnejšej trojrozmernej štruktúry tzv konformácia veverička. Proces tvorby funkčne aktívnej proteínovej konformácie sa nazýva skladanie.
4. Konformácia bielkovín. Voľná rotácia v hlavnom reťazci peptidu je možná medzi atómom dusíka peptidovej skupiny a susedným atómom a-uhlíka, ako aj medzi atómom a-uhlíka a uhlíkom karbonylovej skupiny. Vďaka interakcii funkčných skupín aminokyselinových zvyškov môže primárna štruktúra proteínov nadobudnúť zložitejšie priestorové štruktúry. V globulárnych proteínoch sa rozlišujú dve hlavné úrovne skladania konformácie peptidových reťazcov: sekundárne A terciárna štruktúra.
Sekundárna štruktúra proteínov- je to priestorová štruktúra vytvorená ako výsledok tvorby vodíkových väzieb medzi funkčnými skupinami -C=O a -NH- peptidového hlavného reťazca. V tomto prípade môže peptidový reťazec získať pravidelné štruktúry dvoch typov: a-helixy A β štruktúry.
IN a-helixy vodíkové väzby vznikajú medzi atómom kyslíka karbonylovej skupiny a vodíkom amidového dusíka 4. aminokyseliny z nej; bočné reťazce aminokyselinových zvyškov
umiestnené po obvode špirály, nezúčastňujúce sa na tvorbe sekundárnej štruktúry (obr. 1.3.).
Objemné radikály alebo radikály nesúce rovnaké náboje zabraňujú tvorbe a-helixu. Prolínový zvyšok, ktorý má kruhovú štruktúru, prerušuje a-helix, pretože kvôli nedostatku vodíka na atóme dusíka v peptidovom reťazci nie je možné vytvoriť vodíkovú väzbu. Väzba medzi dusíkom a atómom α-uhlíka je súčasťou prolínového cyklu, takže kostra peptidu nadobúda ohyb v tomto mieste.
β-štruktúra sa tvorí medzi lineárnymi oblasťami peptidového hlavného reťazca jedného polypeptidového reťazca, čím sa vytvárajú zložené štruktúry. Môžu sa tvoriť polypeptidové reťazce alebo ich časti paralelný alebo antiparalelné β-štruktúry. V prvom prípade sa N- a C-konce interagujúcich peptidových reťazcov zhodujú a v druhom prípade majú opačný smer (obr. 1.4).
Ryža. 1.3. Sekundárna štruktúra proteínu - α-helix
 Ryža. 1.4. Paralelné a antiparalelné β-skladané štruktúry
Ryža. 1.4. Paralelné a antiparalelné β-skladané štruktúry
β-štruktúry sú označené širokými šípkami: A - Antiparalelná β-štruktúra. B - Paralelné β-skladané štruktúry
V niektorých proteínoch sa môžu vytvárať β-štruktúry v dôsledku tvorby vodíkových väzieb medzi atómami peptidového hlavného reťazca rôznych polypeptidových reťazcov.
Nachádza sa aj v bielkovinách oblasti s nepravidelným sekundárnymštruktúra, ktorá zahŕňa ohyby, slučky, otáčky polypeptidovej kostry. Často sa nachádzajú na miestach, kde sa mení smer peptidového reťazca, napríklad pri vytváraní paralelnej štruktúry β-listu.
Podľa prítomnosti α-helixov a β-štruktúr možno globulárne proteíny rozdeliť do štyroch kategórií.
Ryža. 1.5. Sekundárna štruktúra myoglobínu (A) a β-reťazca hemoglobínu (B), ktorý obsahuje osem α-helixov
 Ryža. 1.6. Sekundárna štruktúra triózofosfátizomerázovej a pyruvátkinázovej domény
Ryža. 1.6. Sekundárna štruktúra triózofosfátizomerázovej a pyruvátkinázovej domény
 Ryža. 1.7. Sekundárna štruktúra konštantnej domény imunoglobulínu (A) a enzýmu superoxiddismutázy (B)
Ryža. 1.7. Sekundárna štruktúra konštantnej domény imunoglobulínu (A) a enzýmu superoxiddismutázy (B)
IN štvrtej kategórie zahŕňali proteíny, ktoré majú vo svojom zložení malé množstvo pravidelných sekundárnych štruktúr. Tieto proteíny zahŕňajú malé proteíny bohaté na cysteín alebo metaloproteíny.
Terciárna štruktúra proteínu- typ konformácie, ktorá vzniká v dôsledku interakcií medzi radikálmi aminokyselín, ktoré sa môžu v peptidovom reťazci nachádzať v značnej vzdialenosti od seba. V tomto prípade väčšina proteínov tvorí priestorovú štruktúru pripomínajúcu globulu (globulárne proteíny).
Keďže hydrofóbne radikály aminokyselín majú tendenciu spájať sa za pomoci tzv hydrofóbne interakcie a intermolekulárnych van der Waalsových síl sa vo vnútri proteínovej globule vytvorí husté hydrofóbne jadro. Hydrofilné ionizované a neionizované radikály sa nachádzajú hlavne na povrchu proteínu a určujú jeho rozpustnosť vo vode.
 Ryža. 1.8. Typy väzieb, ktoré vznikajú medzi aminokyselinovými radikálmi pri tvorbe terciárnej štruktúry proteínu
Ryža. 1.8. Typy väzieb, ktoré vznikajú medzi aminokyselinovými radikálmi pri tvorbe terciárnej štruktúry proteínu
1 - iónová väzba- vyskytuje sa medzi kladne a záporne nabitými funkčnými skupinami;
2 - vodíková väzba- vyskytuje sa medzi hydrofilnou nenabitou a akoukoľvek inou hydrofilnou skupinou;
3 - hydrofóbne interakcie- vyskytujú sa medzi hydrofóbnymi radikálmi;
4 - disulfidovú väzbu- vzniká oxidáciou SH-skupín cysteínových zvyškov a ich vzájomnou interakciou
Hydrofilné aminokyselinové zvyšky vo vnútri hydrofóbneho jadra môžu navzájom interagovať pomocou iónový A vodíkové väzby(obr. 1.8).
Iónové a vodíkové väzby, ako aj hydrofóbne interakcie patria medzi slabé: ich energia mierne prevyšuje energiu tepelného pohybu molekúl pri izbová teplota. Proteínová konformácia je udržiavaná výskytom mnohých takýchto slabých väzieb. Keďže atómy, z ktorých sa proteín skladá, sú v neustálom pohybe, je možné niektoré slabé väzby rozbiť a iné vytvoriť, čo vedie k malým pohybom jednotlivých úsekov polypeptidového reťazca. Táto vlastnosť proteínov meniť konformáciu v dôsledku rozbitia niektorých a vytvorenia iných slabých väzieb sa nazýva konformačná labilita.
Ľudské telo má systémy, ktoré podporujú homeostázy- stálosť vnútorného prostredia v určitých medziach prijateľných pre zdravý organizmus. V podmienkach homeostázy nerušia malé zmeny v konformácii celková štruktúra a funkciu bielkovín. Funkčne aktívna konformácia proteínu sa nazýva natívnej konformácie. Zmena vnútorného prostredia (napríklad koncentrácia glukózy, Ca iónov, protónov a pod.) vedie k zmene konformácie a narušeniu funkcií bielkovín.
Terciárna štruktúra niektorých proteínov je stabilizovaná disulfidové väzby, vzniká interakciou -SH skupín dvoch zvyškov
 Ryža. 1.9. Tvorba disulfidovej väzby v molekule proteínu
Ryža. 1.9. Tvorba disulfidovej väzby v molekule proteínu
cysteín (obr. 1.9). Väčšina intracelulárnych proteínov nemá vo svojej terciárnej štruktúre kovalentné disulfidové väzby. Ich prítomnosť je charakteristická pre proteíny vylučované bunkou, čo zabezpečuje ich väčšiu stabilitu v extracelulárnych podmienkach. Disulfidové väzby sú teda prítomné v molekulách inzulínu a imunoglobulínov.
inzulín- proteínový hormón syntetizovaný v β-bunkách pankreasu a vylučovaný do krvi ako odpoveď na zvýšenie koncentrácie glukózy v krvi. V štruktúre inzulínu sú dve disulfidové väzby spájajúce polypeptidový A- a B-reťazec a jedna disulfidová väzba vo vnútri A-reťazca (obr. 1.10).
 Ryža. 1.10. Disulfidové väzby v štruktúre inzulínu
Ryža. 1.10. Disulfidové väzby v štruktúre inzulínu
5. Supersekundárna štruktúra bielkovín. V proteínoch sa niekedy líši primárna štruktúra a funkcie podobné kombinácie a vloženie sekundárnych štruktúr, ktoré sa nazývajú supersekundárna štruktúra. Zaberá medzipolohu medzi sekundárnymi a terciárnymi štruktúrami, pretože ide o špecifickú kombináciu prvkov sekundárnej štruktúry počas tvorby terciárnej štruktúry proteínu. Supersekundárne štruktúry majú špecifické názvy ako „α-helix-turn-a-helix“, „leucínový zips“, „zinkové prsty“ atď. Takéto supersekundárne štruktúry sú charakteristické pre proteíny viažuce DNA.
"Leucínový zips". Tento druh super sekundárnej štruktúry sa používa na spojenie dvoch proteínov. Na povrchu interagujúcich proteínov sú a-helikálne oblasti obsahujúce aspoň štyri leucínové zvyšky. Leucínové zvyšky v a-helixe sú umiestnené šesť aminokyselín od seba navzájom. Keďže každý závit α-helixu obsahuje 3,6 aminokyselinových zvyškov, leucínové radikály sa nachádzajú na povrchu každého druhého závitu. Leucínové zvyšky α-helixu jedného proteínu môžu interagovať s leucínovými zvyškami iného proteínu (hydrofóbne interakcie) a spájať ich (obr. 1.11.). Mnohé proteíny viažuce DNA fungujú ako súčasť oligomérnych komplexov, kde sú jednotlivé podjednotky navzájom spojené „leucínovými zipsami“.
 Ryža. 1.11. "Leucínový zips" medzi a-helikálnymi oblasťami dvoch proteínov
Ryža. 1.11. "Leucínový zips" medzi a-helikálnymi oblasťami dvoch proteínov
Príkladom takýchto proteínov sú históny. Históny- jadrové proteíny, medzi ktoré patrí veľké množstvo pozitívne nabité aminokyseliny - arginín a lyzín (až 80%). Molekuly histónu sú spojené do oligomérnych komplexov obsahujúcich osem monomérov pomocou „leucínových spojovacích prostriedkov“ napriek výraznému homonymnému náboju týchto molekúl.
"Zinkový prst"- variant supersekundárnej štruktúry, charakteristický pre proteíny viažuce DNA, má na povrchu proteínu formu predĺženého fragmentu a obsahuje asi 20 aminokyselinových zvyškov (obr. 1.12). Tvar "natiahnutého prsta" je podporovaný atómom zinku spojeným so štyrmi aminokyselinovými radikálmi - dvoma cysteínovými zvyškami a dvoma histidínovými zvyškami. V niektorých prípadoch sú namiesto histidínových zvyškov cysteínové zvyšky. Dva tesne umiestnené cysteínové zvyšky sú oddelené od ďalších dvoch zvyškov Gisili pomocou Cys sekvencie s približne 12 aminokyselinovými zvyškami. Táto oblasť proteínu tvorí a-helix, ktorého radikály sa môžu špecificky viazať na regulačné oblasti hlavnej drážky DNA. Špecifickosť väzby jednotlivca
 Ryža. 1.12. Primárna štruktúra časti proteínov viažucich DNA, ktoré tvoria štruktúru „zinkového prsta“ (písmená označujú aminokyseliny, ktoré tvoria túto štruktúru)
Ryža. 1.12. Primárna štruktúra časti proteínov viažucich DNA, ktoré tvoria štruktúru „zinkového prsta“ (písmená označujú aminokyseliny, ktoré tvoria túto štruktúru)
regulačný proteín viažuci DNA závisí od sekvencie aminokyselinových zvyškov umiestnených v "zinkovom prste". Takéto štruktúry obsahujú najmä receptory pre steroidné hormóny, ktoré sa podieľajú na regulácii transkripcie (čítanie informácií z DNA do RNA).
TÉMA 1.2. ZÁKLADY FUNGOVANIA PROTEÍNOV. DROGY AKO LIGANDY OVPLYVŇUJÚCE FUNKCIU PROTEÍNOV
1. Aktívne centrum proteínu a jeho interakcia s ligandom. Počas tvorby terciárnej štruktúry sa na povrchu funkčne aktívneho proteínu, zvyčajne v vybraní, vytvorí miesto tvorené radikálmi aminokyselín, ktoré sú v primárnej štruktúre ďaleko od seba. Toto miesto, ktoré má jedinečnú štruktúru pre daný proteín a je schopné špecificky interagovať s určitou molekulou alebo skupinou podobných molekúl, sa nazýva väzbové miesto proteínu s ligandom alebo aktívne miesto. Ligandy sú molekuly, ktoré interagujú s proteínmi.
Vysoká špecifickosť Interakcia proteínu s ligandom je zabezpečená komplementaritou štruktúry aktívneho centra so štruktúrou ligandu.
komplementárnosť je priestorová a chemická zhoda interagujúcich povrchov. Aktívne centrum musí nielen priestorovo zodpovedať ligandu v ňom obsiahnutému, ale aj medzi funkčnými skupinami radikálov obsiahnutých v aktívnom centre a ligandom musia byť vytvorené väzby (iónové, vodíkové a hydrofóbne interakcie), ktoré udržujú ligand v aktívnom centre (obr. 1.13).
 Ryža. 1.13. Komplementárna interakcia proteínu s ligandom
Ryža. 1.13. Komplementárna interakcia proteínu s ligandom
Niektoré ligandy, keď sú pripojené k aktívnemu centru proteínu, hrajú pomocnú úlohu pri fungovaní proteínov. Takéto ligandy sa nazývajú kofaktory a proteíny, ktoré majú vo svojom zložení neproteínovú časť komplexné bielkoviny(na rozdiel od jednoduchých bielkovín, pozostávajúcich len z bielkovinovej časti). Nebielkovinová časť, ktorá je pevne spojená s bielkovinou, sa nazýva tzv protetická skupina. Napríklad zloženie myoglobínu, hemoglobínu a cytochrómov obsahuje protetickú skupinu pevne pripojenú k aktívnemu centru - hem obsahujúci železitý ión. Komplexné proteíny obsahujúce hém sa nazývajú hemoproteíny.
Keď sú na proteíny pripojené špecifické ligandy, prejaví sa funkcia týchto proteínov. Albumín, najdôležitejší proteín v krvnej plazme, teda prejavuje svoju transportnú funkciu naviazaním hydrofóbnych ligandov na aktívne centrum, ako sú mastné kyseliny, bilirubín, niektoré lieky atď. (obr. 1.14).
Ligandy interagujúce s trojrozmernou štruktúrou peptidového reťazca môžu byť nielen organické a anorganické molekuly s nízkou molekulovou hmotnosťou, ale aj makromolekuly:
DNA (príklady diskutované vyššie s proteínmi viažucimi DNA);
polysacharidy;
 Ryža. 1.14. Vzťah medzi genotypom a fenotypom
Ryža. 1.14. Vzťah medzi genotypom a fenotypom
Jedinečná primárna štruktúra ľudských proteínov, zakódovaná v molekule DNA, je realizovaná v bunkách vo forme unikátnej konformácie, štruktúry aktívneho miesta a proteínových funkcií.
V týchto prípadoch proteín rozpoznáva špecifickú oblasť ligandu, ktorá je primeraná väzbovému miestu a je k nemu komplementárna. Takže na povrchu hepatocytov sú receptorové proteíny pre hormón inzulín, ktorý má tiež proteínovú štruktúru. Interakcia inzulínu s receptorom spôsobuje zmenu jeho konformácie a aktiváciu signalizačných systémov, čo vedie k akumulácii živín v hepatocytoch po jedle.
teda Fungovanie proteínov je založené na špecifickej interakcii aktívneho centra proteínu s ligandom.
2. Štruktúra domény a jej úloha vo fungovaní proteínov. Dlhé polypeptidové reťazce globulárnych proteínov sa často skladajú do niekoľkých kompaktných, relatívne nezávislých oblastí. Majú nezávislú terciárnu štruktúru, ktorá sa podobá na globulárne proteíny a sú tzv domén. Vďaka doménovej štruktúre proteínov sa ľahšie tvorí ich terciárna štruktúra.
V doménových proteínoch sa miesta viažuce ligand často nachádzajú medzi doménami. Trypsín je teda proteolytický enzým, ktorý je produkovaný exokrinnou časťou pankreasu a je nevyhnutný na trávenie potravinových bielkovín. Má štruktúru dvoch domén a väzobné miesto trypsínu s jeho ligandom – potravinovým proteínom – sa nachádza v drážke medzi týmito dvoma doménami. V aktívnom centre sa vytvárajú podmienky potrebné pre účinnú väzbu konkrétneho miesta potravinového proteínu a hydrolýzu jeho peptidových väzieb.
Rôzne domény v proteíne sa môžu navzájom pohybovať, keď aktívne centrum interaguje s ligandom (obr. 1.15).
Hexokináza- enzým, ktorý pomocou ATP katalyzuje fosforyláciu glukózy. Aktívne miesto enzýmu sa nachádza v štrbine medzi týmito dvoma doménami. Keď sa hexokináza naviaže na glukózu, okolité domény sa uzavrú a substrát sa zachytí, kde dôjde k fosforylácii (pozri obr. 1.15).
 Ryža. 1.15. Väzba hexokinázových domén na glukózu
Ryža. 1.15. Väzba hexokinázových domén na glukózu
V niektorých proteínoch domény vykonávajú nezávislé funkcie väzbou na rôzne ligandy. Takéto proteíny sa nazývajú multifunkčné.
3. Liečivá – ligandy, ktoré ovplyvňujú funkciu bielkovín. Interakcia proteínov s ligandami je špecifická. Vzhľadom na konformačnú labilitu proteínu a jeho aktívneho miesta je však možné zvoliť inú látku, ktorá by mohla interagovať aj s proteínom v aktívnom mieste alebo inej časti molekuly.
Látka, ktorá je štruktúrou podobná prirodzenému ligandu, sa nazýva štruktúrny analóg ligandu alebo neprirodzený ligand. Tiež interaguje s proteínom v aktívnom mieste. Štrukturálny analóg ligandu môže zosilňovať funkciu proteínu (agonista) a znížiť ho (antagonista). Ligand a jeho štruktúrne analógy navzájom súťažia o väzbu proteínu na rovnakom mieste. Takéto látky sú tzv konkurenčné modulátory(regulátory) funkcií bielkovín. Mnohé lieky pôsobia ako proteínové inhibítory. Niektoré z nich sa získavajú chemickou modifikáciou prírodných ligandov. Inhibítory funkcie proteínov môžu byť lieky a jedy.
Atropín je kompetitívny inhibítor M-cholinergných receptorov. Acetylcholín - Prenosový neurotransmiter nervový impulz cez cholinergné synapsie. Na vykonanie excitácie musí acetylcholín uvoľnený do synaptickej štrbiny interagovať s proteínom - receptorom postsynaptickej membrány. Našli sa dva typy cholinergné receptory:
M-receptor okrem acetylcholínu selektívne interaguje s muskarínom (toxín muchovníka). M - cholinergné receptory sú prítomné na hladkých svaloch a pri interakcii s acetylcholínom spôsobujú ich kontrakciu;
H-receptoršpecificky sa viaže na nikotín. N-cholinergné receptory sa nachádzajú v synapsiách priečne pruhovaných kostrových svalov.
špecifický inhibítor M-cholinergné receptory je atropín. Nachádza sa v rastlinách belladonna a henbane.
 Atropín má svojou štruktúrou funkčné skupiny a ich priestorové usporiadanie podobné acetylcholínu, preto patrí ku kompetitívnym inhibítorom M-cholinergných receptorov. Vzhľadom na to, že väzba acetylcholínu na M-cholinergné receptory spôsobuje kontrakciu hladkých svalov, atropín sa používa ako liek, ktorý uvoľňuje ich kŕče. (proti kŕčom). Je teda známe použitie atropínu na uvoľnenie očných svalov pri pohľade na fundus, ako aj na zmiernenie kŕčov pri gastrointestinálnej kolike. M-cholinergné receptory sú prítomné aj v centrálnom nervový systém(CNS), preto môžu veľké dávky atropínu spôsobiť nežiaduce reakcie centrálneho nervového systému: motorické a duševné vzrušenie, halucinácie, kŕče.
Atropín má svojou štruktúrou funkčné skupiny a ich priestorové usporiadanie podobné acetylcholínu, preto patrí ku kompetitívnym inhibítorom M-cholinergných receptorov. Vzhľadom na to, že väzba acetylcholínu na M-cholinergné receptory spôsobuje kontrakciu hladkých svalov, atropín sa používa ako liek, ktorý uvoľňuje ich kŕče. (proti kŕčom). Je teda známe použitie atropínu na uvoľnenie očných svalov pri pohľade na fundus, ako aj na zmiernenie kŕčov pri gastrointestinálnej kolike. M-cholinergné receptory sú prítomné aj v centrálnom nervový systém(CNS), preto môžu veľké dávky atropínu spôsobiť nežiaduce reakcie centrálneho nervového systému: motorické a duševné vzrušenie, halucinácie, kŕče.
Ditilín je kompetitívny agonista H-cholinergných receptorov, ktorý inhibuje funkciu neuromuskulárnych synapsií.
 Neuromuskulárne synapsie kostrových svalov obsahujú H-cholinergné receptory. Ich interakcia s acetylcholínom vedie k svalovým kontrakciám. Pri niektorých chirurgických operáciách, ako aj pri endoskopických štúdiách sa používajú lieky, ktoré spôsobujú relaxáciu kostrových svalov. (svalové relaxanciá). Medzi ne patrí ditylín, ktorý je štruktúrnym analógom acetylcholínu. Viaže sa na H-cholinergné receptory, ale na rozdiel od acetylcholínu ho veľmi pomaly ničí enzým acetylcholínesteráza. V dôsledku predĺženého otvárania iónových kanálov a pretrvávajúcej depolarizácie membrány je narušené vedenie nervového vzruchu a dochádza k svalovej relaxácii. Spočiatku sa tieto vlastnosti našli v jede kurare, preto sa takéto lieky nazývajú kurariformný.
Neuromuskulárne synapsie kostrových svalov obsahujú H-cholinergné receptory. Ich interakcia s acetylcholínom vedie k svalovým kontrakciám. Pri niektorých chirurgických operáciách, ako aj pri endoskopických štúdiách sa používajú lieky, ktoré spôsobujú relaxáciu kostrových svalov. (svalové relaxanciá). Medzi ne patrí ditylín, ktorý je štruktúrnym analógom acetylcholínu. Viaže sa na H-cholinergné receptory, ale na rozdiel od acetylcholínu ho veľmi pomaly ničí enzým acetylcholínesteráza. V dôsledku predĺženého otvárania iónových kanálov a pretrvávajúcej depolarizácie membrány je narušené vedenie nervového vzruchu a dochádza k svalovej relaxácii. Spočiatku sa tieto vlastnosti našli v jede kurare, preto sa takéto lieky nazývajú kurariformný.
TÉMA 1.3. DENATURÁCIA PROTEÍNOV A MOŽNOSŤ ICH SPONTÁNNEJ RENATIVÁCIE
1. Keďže prirodzená konformácia proteínov je zachovaná vďaka slabým interakciám, zmenám v zložení a vlastnostiach prostredia obklopujúceho proteín, vystaveniu chemickým činidlám a fyzikálne faktory spôsobiť zmenu ich konformácie (vlastnosť konformačnej lability). Pretrhnutie veľkého počtu väzieb vedie k deštrukcii natívnej konformácie a denaturácii proteínu.
Denaturácia bielkovín- ide o deštrukciu ich natívnej konformácie pôsobením denaturačných činidiel, spôsobenú rozbitím slabých väzieb, ktoré stabilizujú priestorovú štruktúru proteínu. Denaturácia je sprevádzaná deštrukciou jedinečnej trojrozmernej štruktúry a aktívneho centra proteínu a stratou jeho biologickej aktivity (obr. 1.16).
Všetky denaturované molekuly jedného proteínu získavajú náhodnú konformáciu, ktorá sa líši od iných molekúl toho istého proteínu. Ukazuje sa, že aminokyselinové radikály, ktoré tvoria aktívne centrum, sú od seba priestorovo vzdialené, t.j. špecifické väzbové miesto proteínu s ligandom je zničené. Počas denaturácie zostáva primárna štruktúra proteínov nezmenená.
Použitie denaturačných činidiel v biologickom výskume a medicíne. Pri biochemických štúdiách sa pred stanovením zlúčenín s nízkou molekulovou hmotnosťou v biologickom materiáli zvyčajne najskôr z roztoku odstránia proteíny. Na tento účel sa najčastejšie používa kyselina trichlóroctová (TCA). Po pridaní TCA do roztoku sa vyzrážajú denaturované proteíny a dajú sa ľahko odstrániť filtráciou (tabuľka 1.1.)
V medicíne sa denaturačné činidlá často používajú na sterilizáciu lekárskych nástrojov a materiálu v autoklávoch (denaturačné činidlo - vysoká teplota) a ako antiseptiká (alkohol, fenol, chloramín) na ošetrenie kontaminovaných povrchov obsahujúcich patogénnu mikroflóru.
2. Spontánna regenerácia bielkovín- dôkaz determinizmu primárnej štruktúry, konformácie a funkcie bielkovín. Jednotlivé proteíny sú produkty jedného génu, ktoré majú identickú sekvenciu aminokyselín a v bunke nadobúdajú rovnakú konformáciu. Zásadný záver, že primárna štruktúra proteínu už obsahuje informácie o jeho konformácii a funkcii, bol urobený na základe schopnosti niektorých proteínov (najmä ribonukleázy a myoglobínu) spontánnej renativácie – obnovy ich prirodzenej konformácie po denaturácii.
Tvorba priestorových štruktúr proteínu sa uskutočňuje metódou samoskladania - spontánnym procesom, pri ktorom má polypeptidový reťazec, ktorý má jedinečnú primárnu štruktúru, tendenciu prijímať v roztoku konformáciu s najmenším voľná energia. Schopnosť regenerovať proteíny, ktoré si po denaturácii zachovávajú svoju primárnu štruktúru, bola opísaná v experimente s enzýmom ribonukleázou.
Ribonukleáza je enzým, ktorý štiepi väzby medzi jednotlivými nukleotidmi v molekule RNA. Tento globulárny proteín má jeden polypeptidový reťazec, ktorého terciárna štruktúra je stabilizovaná mnohými slabými a štyrmi disulfidovými väzbami.
Ošetrenie ribonukleázy močovinou, ktorá ruší vodíkové väzby v molekule, a redukčným činidlom, ktoré štiepi disulfidové väzby, vedie k denaturácii enzýmu a strate jeho aktivity.
Odstránenie denaturačných činidiel dialýzou vedie k obnoveniu konformácie a funkcie proteínu, t.j. k reanimácii. (obr. 1.17).
 Ryža. 1.17. Denaturácia a renativácia ribonukleázy
Ryža. 1.17. Denaturácia a renativácia ribonukleázy
A - natívna konformácia ribonukleázy, v terciárnej štruktúre ktorej sú štyri disulfidové väzby; B - denaturovaná molekula ribonukleázy;
B - molekula renatívnej ribonukleázy s obnovenou štruktúrou a funkciou
1. Kompletná tabuľka 1.2.
Tabuľka 1.2. Klasifikácia aminokyselín podľa polarity radikálov
2. Napíšte vzorec tetrapeptidu:
Asp - Pro - Fen - Liz
a) izolovať opakujúce sa skupiny v peptide, ktoré tvoria peptidovú kostru, a variabilné skupiny reprezentované aminokyselinovými radikálmi;
b) označte N- a C-konce;
c) podčiarknuť peptidové väzby;
d) napíšte ďalší peptid pozostávajúci z rovnakých aminokyselín;
e) spočítajte počet možných tetrapeptidových variantov s podobným zložením aminokyselín.
3. Vysvetlite úlohu primárnej štruktúry proteínov na príklade komparatívnej analýzy dvoch štruktúrne podobných a evolučne blízkych peptidových hormónov neurohypofýzy cicavcov - oxytocínu a vazopresínu (tab. 1.3).
Tabuľka 1.3. Štruktúra a funkcia oxytocínu a vazopresínu
 Pre to:
Pre to:
a) porovnať zloženie a sekvenciu aminokyselín týchto dvoch peptidov;
b) nájsť podobnosť primárnej štruktúry týchto dvoch peptidov a podobnosť ich biologického účinku;
c) nájsť rozdiely v štruktúre týchto dvoch peptidov a rozdiel v ich funkciách;
d) vyvodiť záver o vplyve primárnej štruktúry peptidov na ich funkcie.
4. Popíšte hlavné štádiá tvorby konformácie globulárnych proteínov (sekundárne, terciárne štruktúry, pojem supersekundárna štruktúra). Uveďte typy väzieb, ktoré sa podieľajú na tvorbe proteínových štruktúr. Ktoré aminokyselinové radikály sa môžu podieľať na tvorbe hydrofóbnych interakcií, iónových, vodíkových väzieb.
Uveďte príklady.
5. Definujte pojem „konformačná labilita proteínov“, uveďte dôvody jeho existencie a význam.
6. Vysvetlite význam nasledujúcej frázy: „Funkcia proteínov je založená na ich špecifickej interakcii s ligandom“ pomocou pojmov a vysvetlite ich význam: konformácia proteínu, aktívne miesto, ligand, komplementarita, funkcia proteínu.
7. Na jednom z príkladov vysvetlite, čo sú domény a aká je ich úloha vo fungovaní proteínov.
ÚLOHY PRE SEBAOVLÁDANIE
1. Nastavte zhodu.
Funkčná skupina v aminokyselinovom radikále:
A. Karboxylová skupina B. Hydroxylová skupina C Guanidínová skupina D. Tiolová skupina E. Aminoskupina
2. Vyberte správne odpovede.
Aminokyseliny s polárnymi nenabitými radikálmi sú:
A. Tsis B. Asn
B. Glu G. Tri
3. Vyberte správne odpovede.
Radikály aminokyselín:
A. Poskytnúť špecifickosť primárnej štruktúry B. Podieľať sa na tvorbe terciárnej štruktúry
B. Tým, že sa nachádzajú na povrchu proteínu, ovplyvňujú jeho rozpustnosť D. Tvoria aktívne centrum
D. Podieľať sa na tvorbe peptidových väzieb
4. Vyberte správne odpovede.
Medzi aminokyselinovými radikálmi sa môžu vytvárať hydrofóbne interakcie:
A. Tre Lay B. Pro Tri
B. Met Ile G. Tir Ala D. Val Fen
5. Vyberte správne odpovede.
Medzi aminokyselinovými radikálmi sa môžu vytvárať iónové väzby:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Husi Asp D. Asn Apr
6. Vyberte správne odpovede.
Medzi aminokyselinovými radikálmi sa môžu vytvárať vodíkové väzby:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Nastavte zhodu.
Typ väzby zapojený do tvorby proteínovej štruktúry:
A. Primárna štruktúra B. Sekundárna štruktúra
B. Terciárna štruktúra
D. Supersekundárna štruktúra E. Konformácia.
1. Vodíkové väzby medzi atómami peptidového hlavného reťazca
2. Slabé väzby medzi funkčnými skupinami aminokyselinových radikálov
3. Väzby medzi α-amino a α-karboxylovými skupinami aminokyselín
8. Vyberte správne odpovede. Trypsín:
A. Proteolytický enzým B. Obsahuje dve domény
B. Hydrolyzuje škrob
D. Aktívne centrum sa nachádza medzi doménami. D. Pozostáva z dvoch polypeptidových reťazcov.
9. Vyberte správne odpovede. Atropín:
A. Neurotransmiter
B. Štrukturálny analóg acetylcholínu
B. Interaguje s H-cholinergnými receptormi
G. Zvyšuje vedenie nervového vzruchu cez cholinergné synapsie
D. Kompetitívny inhibítor M-cholinergných receptorov
10. Vyberte správne tvrdenia. V bielkovinách:
A. Primárna štruktúra obsahuje informácie o štruktúre jej aktívneho miesta
B. Aktívne centrum sa tvorí na úrovni primárnej štruktúry
B. Konformácia je pevne fixovaná kovalentnými väzbami
D. Aktívne miesto môže interagovať so skupinou podobných ligandov
v dôsledku konformačnej lability proteínov D. Zmena životné prostredie, môže ovplyvniť afinitu aktívnej látky
centrum k ligandu
1. 1-C, 2-D, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
ZÁKLADNÉ POJMY A POJMY
1. Proteín, polypeptid, aminokyseliny
2. Primárne, sekundárne, terciárne proteínové štruktúry
3. Konformácia, natívna bielkovinová konformácia
4. Kovalentné a slabé väzby v proteíne
5. Konformačná labilita
6. Proteínové aktívne miesto
7. Ligandy
8. Skladanie bielkovín
9. Štruktúrne analógy ligandov
10. Doménové proteíny
11. Jednoduché a zložité bielkoviny
12. Denaturácia bielkovín, denaturačné činidlá
13. Regenerácia bielkovín
Riešiť problémy
"Štrukturálna organizácia bielkovín a základ ich fungovania"
1. Hlavnou funkciou proteínu - hemoglobínu A (HbA) - je transport kyslíka do tkanív. známy v ľudskej populácii tvary množného čísla tohto proteínu so zmenenými vlastnosťami a funkciou – takzvané abnormálne hemoglobíny. Napríklad sa zistilo, že hemoglobín S nachádzajúci sa v erytrocytoch pacientov s kosáčikovitou anémiou (HbS) má nízku rozpustnosť v podmienkach nízkeho parciálneho tlaku kyslíka (ako sa vyskytuje vo venóznej krvi). To vedie k tvorbe agregátov tohto proteínu. Proteín stráca svoju funkciu, zráža sa a získavajú erytrocyty nepravidelný tvar(niektoré z nich tvoria kosáčikovitý tvar) a v slezine sa ničia rýchlejšie ako zvyčajne. V dôsledku toho sa vyvíja kosáčikovitá anémia.
Jediný rozdiel v primárnej štruktúre HvA bol nájdený v N-terminálnej oblasti β-reťazca hemoglobínu. Porovnajte N-terminálne oblasti β-reťazca a ukážte, ako zmeny v primárnej štruktúre proteínu ovplyvňujú jeho vlastnosti a funkcie.
 Pre to:
Pre to:
a) napíšte vzorce aminokyselín, ktorými sa HvA líšia a porovnajte vlastnosti týchto aminokyselín (polarita, náboj).
b) vyvodiť záver o dôvode zníženia rozpustnosti a narušenia transportu kyslíka v tkanive.
2. Obrázok ukazuje schému štruktúry proteínu, ktorý má centrum viažuce ligand (aktívne centrum). Vysvetlite, prečo je proteín selektívny pri výbere ligandu. Pre to:
a) zapamätajte si, čo je aktívne centrum proteínu, a zvážte štruktúru aktívneho centra proteínu znázorneného na obrázku;
b) napíšte vzorce radikálov aminokyselín, ktoré tvoria aktívne centrum;
c) nakreslite ligand, ktorý by mohol špecificky interagovať s aktívnym miestom proteínu. Označte na ňom funkčné skupiny schopné vytvárať väzby s aminokyselinovými radikálmi, ktoré tvoria aktívne centrum;
d) označujú typy väzieb, ktoré vznikajú medzi ligandom a aminokyselinovými radikálmi aktívneho centra;
e) Vysvetlite základ pre špecifickosť interakcie proteínu s ligandom.
 3.
Obrázok ukazuje aktívne miesto proteínu a niekoľko ligandov.
3.
Obrázok ukazuje aktívne miesto proteínu a niekoľko ligandov.
Určte, ktorý z ligandov s najväčšou pravdepodobnosťou interaguje s aktívnym miestom proteínu a prečo.
 Aké typy väzieb vznikajú pri tvorbe komplexu proteín-ligand?
Aké typy väzieb vznikajú pri tvorbe komplexu proteín-ligand?
4. Štrukturálne analógy prirodzených proteínových ligandov sa môžu použiť ako liečivá na zmenu aktivity proteínov.
Acetylcholín je mediátorom prenosu excitácie v neuromuskulárnych synapsiách. Keď acetylcholín interaguje s proteínmi - receptormi postsynaptickej membrány kostrových svalov, otvárajú sa iónové kanály a dochádza k svalovej kontrakcii. Dithylín je liek používaný pri niektorých operáciách na uvoľnenie svalov, pretože narúša prenos nervových vzruchov cez neuromuskulárne synapsie. Vysvetlite mechanizmus účinku ditylínu ako lieku na uvoľnenie svalov. Pre to:
a) napíšte vzorce acetylcholínu a ditylínu a porovnajte ich štruktúru;
b) opíšte mechanizmus relaxačného účinku ditylínu.
5. Pri niektorých ochoreniach sa telesná teplota pacienta zvyšuje, čo sa považuje za ochrannú reakciu tela. Vysoké teploty však telovým bielkovinám škodia. Vysvetlite, prečo pri teplotách nad 40 °C dochádza k narušeniu funkcie bielkovín a k ohrozeniu ľudského života. Ak to chcete urobiť, nezabudnite:
1) Štruktúra proteínov a väzieb, ktoré držia ich štruktúru v natívnej konformácii;
2) Ako sa mení štruktúra a funkcia bielkovín so zvyšujúcou sa teplotou?;
3) Čo je homeostáza a prečo je dôležité udržiavať zdravie človeka.
Modulárna jednotka 2 OLIGOMERICKÉ BIELKOVINY AKO CIELE PRE VPLYV NA REGULÁCIU. ŠTRUKTURÁLNA A FUNKČNÁ ROZMANITOSŤ PROTEÍNOV. METÓDY SEPARÁCIE A ČISTENIA PROTEÍNOV
Ciele vzdelávania Byť schopný:
1. Využiť poznatky o vlastnostiach štruktúry a funkcií oligomérnych proteínov na pochopenie adaptívnych mechanizmov regulácie ich funkcií.
2. Vysvetlite úlohu chaperónov pri syntéze a udržiavaní proteínovej konformácie v bunke.
3. Vysvetliť rozmanitosť prejavov života rozmanitosťou štruktúr a funkcií bielkovín syntetizovaných v organizme.
4. Analyzujte vzťah medzi štruktúrou proteínov a ich funkciou porovnaním príbuzných hemoproteínov – myoglobínu a hemoglobínu, ako aj zástupcov piatich tried proteínov z rodiny imunoglobulínov.
5. Aplikovať poznatky o vlastnostiach fyzikálno-chemických vlastností proteínov na výber metód ich čistenia od iných proteínov a nečistôt.
6. Interpretujte výsledky kvantitatívneho a kvalitatívneho zloženia bielkovín krvnej plazmy na potvrdenie alebo objasnenie klinickej diagnózy.
Vedieť:
1. Vlastnosti štruktúry oligomérnych proteínov a adaptívne mechanizmy regulácie ich funkcií na príklade hemoglobínu.
2. Štruktúra a funkcie chaperónov a ich význam pre udržanie prirodzenej konformácie proteínov v bunke.
3. Princípy zoskupovania proteínov do rodín podľa podobnosti ich konformácie a funkcií na príklade imunoglobulínov.
4. Metódy separácie proteínov založené na znakoch ich fyzikálno-chemických vlastností.
5. Elektroforéza krvnej plazmy ako metóda hodnotenia kvalitatívneho a kvantitatívneho zloženia bielkovín.
TÉMA 1.4. VLASTNOSTI ŠTRUKTÚRY A FUNGOVANIA OLIGOMERICKÝCH PROTEÍNOV NA PRÍKLADE HEMOGLOBÍNU
1. Mnohé proteíny obsahujú niekoľko polypeptidových reťazcov. Takéto bielkoviny sa nazývajú oligomérny, a jednotlivé okruhy protoméry. Protoméry v oligomérnych proteínoch sú spojené mnohými slabými nekovalentnými väzbami (hydrofóbne, iónové, vodíkové). Interakcia
protomérov sa uskutočňuje vďaka komplementárnosť ich kontaktné plochy.
Počet protomérov v oligomérnych proteínoch sa môže značne líšiť: hemoglobín obsahuje 4 protoméry, enzým aspartátaminotransferáza - 12 protomérov a proteín vírusu tabakovej mozaiky obsahuje 2120 protomérov spojených nekovalentnými väzbami. Preto môžu mať oligomérne proteíny veľmi vysoké molekulové hmotnosti.
Interakciu jedného protoméru s inými možno považovať za špeciálny prípad interakcie proteínu s ligandom, pretože každý protomér slúži ako ligand pre iné protoméry. Počet a spôsob spojenia protomérov v proteíne je tzv kvartérna proteínová štruktúra.
Proteíny môžu obsahovať protoméry rovnakej alebo odlišnej štruktúry, napríklad homodiméry sú proteíny obsahujúce dva identické protoméry a heterodiméry sú proteíny obsahujúce dva rôzne protoméry.
Ak proteíny obsahujú rôzne protoméry, môžu sa na nich vytvárať väzbové centrá s rôznymi ligandami, ktoré sa líšia štruktúrou. Keď sa ligand naviaže na aktívne centrum, prejaví sa funkcia tohto proteínu. Centrum nachádzajúce sa na inom protoméri sa nazýva alosterické (iné ako aktívne). Kontaktovanie alosterický ligand alebo efektor, plní regulačnú funkciu (obr. 1.18). Interakcia alosterického centra s efektorom spôsobuje konformačné zmeny v štruktúre celého oligomérneho proteínu v dôsledku jeho konformačnej lability. To ovplyvňuje afinitu aktívneho miesta pre špecifický ligand a reguluje funkciu tohto proteínu. Zmena v konformácii a funkcii všetkých protomérov počas interakcie oligomérneho proteínu s aspoň jedným ligandom sa nazýva kooperatívna zmena konformácie. Efektory, ktoré zlepšujú funkciu proteínov, sa nazývajú aktivátory a efektory, ktoré potláčajú jeho funkciu - inhibítory.
V oligomérnych proteínoch, ako aj proteínoch s doménovou štruktúrou sa teda v porovnaní s monomérnymi proteínmi objavuje nová vlastnosť - schopnosť alosterickej regulácie funkcií (regulácia naviazaním rôznych ligandov na proteín). To možno vidieť porovnaním štruktúr a funkcií dvoch úzko súvisiacich komplexných proteínov myoglobínu a hemoglobínu.
 Ryža. 1.18. Schéma štruktúry dimérneho proteínu
Ryža. 1.18. Schéma štruktúry dimérneho proteínu
2. Tvorba priestorových štruktúr a fungovanie myoglobínu.
Myoglobín (Mb) je proteín nachádzajúci sa v červených svaloch, ktorého hlavnou funkciou je vytváranie zásob O 2 potrebných pre intenzívnu svalovú prácu. MB je komplexný proteín obsahujúci bielkovinovú časť – apoMB a nebielkovinovú časť – hem. Primárna štruktúra apoMB určuje jeho kompaktnú globulárnu konformáciu a štruktúru aktívneho centra, ku ktorému je pripojená neproteínová časť myoglobínu, hem. Kyslík z krvi do svalov sa viaže na Fe + 2 hem v zložení myoglobínu. MB je monomérny proteín s veľmi vysokou afinitou k O 2, preto sa kyslík uvoľňuje myoglobínom len pri intenzívnej svalovej práci, kedy parciálny tlak O 2 prudko klesá.
Tvorba konformácie MB. V červených svaloch na ribozómoch počas translácie prebieha syntéza primárnej štruktúry MB, ktorú predstavuje špecifická sekvencia 153 aminokyselinových zvyškov. Sekundárna štruktúra Mv obsahuje osem α-helixov, nazývaných latinské písmená od A po H, medzi ktorými sú nešpiralizované úseky. Terciárna štruktúra Mv má podobu kompaktnej globule, v ktorej vybraní medzi F a E α-helixami je aktívne centrum (obr. 1.19).
 Ryža. 1.19. Štruktúra myoglobínu
Ryža. 1.19. Štruktúra myoglobínu
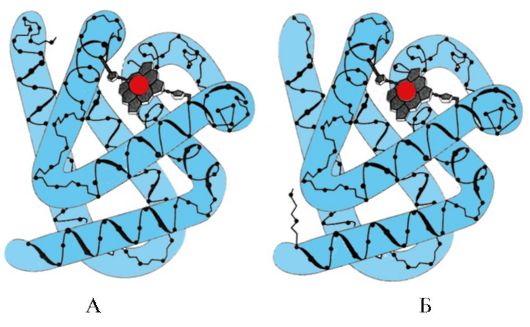
3. Vlastnosti štruktúry a fungovania aktívneho centra MV. Aktívne centrum Mv je tvorené najmä hydrofóbnymi radikálmi aminokyselín, ktoré sú v primárnej štruktúre od seba vzdialené (napríklad Tri 3 9 a Phen 138) Ligandy slabo rozpustné vo vode, hém a 02, sú pripojené k aktívnemu centru. Hem je špecifický apoMv ligand (obr. 1.20), ktorý je založený na štyroch pyrolových kruhoch spojených metenylovými mostíkmi; v strede je atóm Fe+2 spojený s atómami dusíka pyrolových kruhov štyrmi koordinačnými väzbami. Okrem hydrofóbnych radikálov aminokyselín obsahuje aktívne centrum Mv aj zvyšky dvoch aminokyselín s hydrofilnými radikálmi - Gis E 7(Gis 64) a Gis F 8(Jeho 93) (obr. 1.21).
 Ryža. 1.20. Štruktúra hemu - neproteínová časť myoglobínu a hemoglobínu
Ryža. 1.20. Štruktúra hemu - neproteínová časť myoglobínu a hemoglobínu
 Ryža. 1.21. Umiestnenie hemu a O 2 v aktívnom mieste apomyoglobínu a protomérov hemoglobínu
Ryža. 1.21. Umiestnenie hemu a O 2 v aktívnom mieste apomyoglobínu a protomérov hemoglobínu
Hem je kovalentne viazaný na His F8 cez atóm železa. O 2 sa pripája k žehličke na druhej strane roviny hemu. Jeho E 7 je nevyhnutný pre správnu orientáciu O 2 a uľahčuje pridávanie kyslíka do Fe + 2 hemu
Gis F 8 vytvára koordinačnú väzbu s Fe+ 2 a pevne fixuje hém v aktívnom centre. Gis E 7 je nevyhnutný pre správnu orientáciu v aktívnom centre iného ligandu - O 2 pri jeho interakcii s Fe + 2 hem. Hémové mikroprostredie vytvára podmienky pre silnú, ale reverzibilnú väzbu O 2 s Fe + 2 a zabraňuje vstupu vody do hydrofóbneho aktívneho centra, čo môže viesť k jeho oxidácii na Fe + 3.
Monomérna štruktúra MB a jej aktívne centrum určuje vysokú afinitu proteínu k O2.
4. Oligomérna štruktúra Hb a regulácia afinity Hb k O 2 pomocou ligandov. Ľudské hemoglobíny- rodina proteínov, ako aj myoglobín súvisiaci s komplexnými proteínmi (hemoproteíny). Majú tetramérnu štruktúru a obsahujú dva α-reťazce, líšia sa však štruktúrou ďalších dvoch polypeptidových reťazcov (2α-, 2x-reťazce). Štruktúra druhého polypeptidového reťazca určuje vlastnosti fungovania týchto foriem Hb. Asi 98% hemoglobínu v dospelých erytrocytoch je hemoglobín A(2a-, 2p-reťazce).
Počas vývoja plodu existujú dva hlavné typy hemoglobínov: embryonálny HB(2α, 2ε), ktorý sa nachádza v skorých štádiách vývoja plodu, a hemoglobín F (fetálny)- (2α, 2γ), ktorý nahrádza skorý fetálny hemoglobín v šiestom mesiaci vývoja plodu a je nahradený Hb A až po narodení.
Hv A je proteín súvisiaci s myoglobínom (Mv), ktorý sa nachádza v dospelých erytrocytoch. Štruktúra jeho jednotlivých protomérov je podobná štruktúre myoglobínu. Sekundárne a terciárne štruktúry myoglobínu a protomérov hemoglobínu sú veľmi podobné, napriek tomu, že iba 24 aminokyselinových zvyškov je identických v primárnej štruktúre ich polypeptidových reťazcov (sekundárna štruktúra protomérov hemoglobínu, podobne ako myoglobín, obsahuje osem α-helixov, označujú sa latinskými písmenami od A do H a terciárna štruktúra má formu kompaktnej globule). Ale na rozdiel od myoglobínu má hemoglobín oligomérnu štruktúru, pozostáva zo štyroch polypeptidových reťazcov spojených nekovalentnými väzbami (obrázok 1.22).
Každý protomér Hb je spojený s neproteínovou časťou – hemom a susednými protomérmi. Spojenie proteínovej časti Hb s hemom je podobné ako pri myoglobíne: v aktívnom centre proteínu sú hydrofóbne časti hemu obklopené hydrofóbnymi aminokyselinovými radikálmi, s výnimkou His F 8 a His E 7 , ktoré sa nachádzajú na oboch stranách hemovej roviny a hrajú podobnú úlohu vo fungovaní proteínu a jeho väzbe s kyslíkom (pozri štruktúru myoglobínu).
 Ryža. 1.22. Oligomérna štruktúra hemoglobínu
Ryža. 1.22. Oligomérna štruktúra hemoglobínu
okrem toho Gis E 7 vykonáva dôležitú dodatočnú úlohu vo fungovaní NV. Voľný hem má 25 000-krát vyššiu afinitu k CO ako k O 2 . CO sa v tele tvorí v malom množstve a vzhľadom na svoju vysokú afinitu k hému by mohol narušiť transport O 2 potrebný pre život buniek. V zložení hemoglobínu však afinita hemu k oxidu uhoľnatému prevyšuje afinitu k O 2 len 200-krát v dôsledku prítomnosti E 7 v aktívnom centre His. Zvyšok tejto aminokyseliny vytvára optimálne podmienky pre väzbu hemu na O2 a oslabuje interakciu hemu s CO.
5. Hlavnou funkciou Hb je transport O 2 z pľúc do tkanív. Na rozdiel od monomérneho myoglobínu, ktorý má veľmi vysokú afinitu k O 2 a plní funkciu ukladania kyslíka v červených svaloch, oligomérna štruktúra hemoglobínu poskytuje:
1) rýchle nasýtenie Hb kyslíkom v pľúcach;
2) schopnosť Hb uvoľňovať kyslík v tkanivách pri relatívne vysokom parciálnom tlaku O2 (20-40 mm Hg);
3) možnosť regulácie afinity Hb k O 2 .
6. Kooperatívne zmeny v konformácii protomérov hemoglobínu urýchľujú väzbu O 2 v pľúcach a jeho návrat do tkanív. V pľúcach vysoký parciálny tlak O2 podporuje jeho väzbu na Hb v aktívnom mieste štyroch protomérov (2α a 2β). Aktívne centrum každého protoméru, ako v myoglobíne, sa nachádza medzi dvoma a-helixami (F a E) v hydrofóbnom vrecku. Obsahuje neproteínovú časť - hem, naviazanú na bielkovinovú časť mnohými slabými hydrofóbnymi interakciami a jednu silnú väzbu medzi Fe 2 + hem a His F 8 (pozri obr. 1.21).
V deoxyhemoglobíne v dôsledku tohto spojenia s His F 8 atóm Fe 2 + vyčnieva z hémovej roviny smerom k histidínu. K väzbe O 2 na Fe 2 + dochádza na druhej strane hemu v oblasti His E 7 pomocou jedinej voľnej koordinačnej väzby. Jeho E 7 poskytuje optimálne podmienky pre väzbu O 2 s hemovým železom.
Pridanie 02 k atómu Fe +2 jedného protoméru spôsobí, že sa presunie do hémovej roviny a za ňou s ním spojený histidínový zvyšok
 Ryža. 1.23. Zmena konformácie protoméru hemoglobínu pri kombinácii s O2
Ryža. 1.23. Zmena konformácie protoméru hemoglobínu pri kombinácii s O2
To vedie k zmene konformácie všetkých polypeptidových reťazcov v dôsledku ich konformačnej lability. Zmena konformácie iných reťazcov uľahčuje ich interakciu s ďalšími molekulami O2.
Štvrtá molekula O 2 sa viaže na hemoglobín 300-krát ľahšie ako prvá (obr. 1.24).
 Ryža. 1.24. Kooperatívne zmeny v konformácii protomérov hemoglobínu počas jeho interakcie s O2
Ryža. 1.24. Kooperatívne zmeny v konformácii protomérov hemoglobínu počas jeho interakcie s O2
V tkanivách sa každá nasledujúca molekula O2 ľahšie odštiepi ako predchádzajúca, a to aj v dôsledku kooperatívnych zmien v konformácii protoméru.
7. CO 2 a H + vznikajúce pri katabolizme organickej hmoty znižujú afinitu hemoglobínu k O 2 úmerne ich koncentrácii. Energia potrebná pre fungovanie buniek vzniká najmä v mitochondriách pri oxidácii organických látok pomocou O 2 dodávaného z pľúc hemoglobínom. V dôsledku oxidácie organických látok konečné produkty ich rozpad: CO 2 a K 2 O, ktorých množstvo je úmerné intenzite prebiehajúcich oxidačných procesov.
CO 2 difunduje z buniek do krvi a preniká do erytrocytov, kde sa pôsobením enzýmu karbanhydrázy mení na kyselina uhličitá. Táto slabá kyselina disociuje na protónový a hydrogénuhličitanový ión.
H+ sú schopní pripojiť sa k radikálom GIS 14 6 v α- a β-reťazcoch hemoglobínu, t.j. v oblastiach vzdialených od hemu. Protonácia hemoglobínu znižuje jeho afinitu k O 2, podporuje elimináciu O 2 z oxyHb, tvorbu deoxyHb a zvyšuje prísun kyslíka do tkanív úmerne k počtu vytvorených protónov (obr. 1.25).
Nárast množstva uvoľneného kyslíka v závislosti od zvýšenia koncentrácie H + v erytrocytoch sa nazýva Bohrov efekt (podľa dánskeho fyziológa Christiana Bohra, ktorý tento efekt objavil ako prvý).
V pľúcach vysoký parciálny tlak kyslíka podporuje jeho väzbu na deoxyHb, čo znižuje afinitu proteínu k H+. Uvoľnené protóny pôsobením karbanhydrázy interagujú s hydrogénuhličitanmi za vzniku CO 2 a H 2 O

 Ryža. 1.25. Závislosť afinity Hb k O 2 od koncentrácie CO 2 a protónov (Bohrov efekt):
Ryža. 1.25. Závislosť afinity Hb k O 2 od koncentrácie CO 2 a protónov (Bohrov efekt):
A- vplyv koncentrácie CO 2 a H+ na uvoľňovanie O 2 z komplexu s Hb (Bohrov efekt); B- okysličenie deoxyhemoglobínu v pľúcach, tvorba a uvoľňovanie CO 2 .
Vzniknutý CO 2 vstupuje do alveolárneho priestoru a je odstraňovaný vydychovaným vzduchom. Množstvo kyslíka uvoľneného hemoglobínom v tkanivách je teda regulované produktmi katabolizmu organických látok: čím intenzívnejší je rozklad látok, napríklad pri fyzickej námahe, tým vyššia je koncentrácia CO 2 a H + a tým viac kyslík, ktorý tkanivá dostávajú v dôsledku zníženia afinity H k O2.
8. Allosterická regulácia afinity Hb k O 2 ligandom - 2,3-bisfosfoglycerátom. V erytrocytoch sa alosterický ligand hemoglobínu, 2,3-bisfosfoglycerát (2,3-BPG), syntetizuje z produktu oxidácie glukózy – 1,3-bisfosfoglycerátu. Za normálnych podmienok je koncentrácia 2,3-BPG vysoká a porovnateľná s koncentráciou Hb. 2,3-BPG má silný záporný náboj -5.
 Bisfosfoglycerát v tkanivových kapilárach väzbou na deoxyhemoglobín zvyšuje výdaj kyslíka v tkanivách, čím sa znižuje afinita Hb k O 2 .
Bisfosfoglycerát v tkanivových kapilárach väzbou na deoxyhemoglobín zvyšuje výdaj kyslíka v tkanivách, čím sa znižuje afinita Hb k O 2 .
V strede molekuly tetramérneho hemoglobínu je dutina. Tvoria ho aminokyselinové zvyšky všetkých štyroch protomérov (pozri obr. 1.22). V tkanivových kapilárach protonácia Hb (Bohrov efekt) preruší väzbu medzi hémovým železom a O 2 . V molekule
deoxyhemoglobínu sa v porovnaní s oxyhemoglobínom objavujú ďalšie iónové väzby, ktoré spájajú protoméry, v dôsledku čoho sa veľkosť centrálnej dutiny v porovnaní s oxyhemoglobínom zväčšuje. Centrálna dutina je miestom pripojenia 2,3-BPG k hemoglobínu. V dôsledku rozdielu vo veľkosti centrálnej dutiny sa 2,3-BPG môže pripojiť iba k deoxyhemoglobínu.
2,3-BPG interaguje s hemoglobínom v oblasti vzdialenej od aktívnych miest proteínu, do ktorej patrí alosterický(regulačné) ligandy a centrálna dutina Hb je alosterické centrum. 2,3-BPG má silný negatívny náboj a interaguje s piatimi kladne nabitými skupinami dvoch Hb β-reťazcov: N-terminálnou α-aminoskupinou Val a radikálmi Lys 82 Gis 143 (obr. 1.26).
 Ryža. 1.26. BPG v centrálnej dutine deoxyhemoglobínu
Ryža. 1.26. BPG v centrálnej dutine deoxyhemoglobínu
BPG sa viaže na tri pozitívne nabité skupiny v každom p-vlákne.
V tkanivových kapilárach výsledný deoxyhemoglobín interaguje s 2,3-BPG a medzi kladne nabitými radikálmi β-reťazcov a záporne nabitým ligandom sa vytvárajú iónové väzby, ktoré menia konformáciu proteínu a znižujú afinitu Hb k O 2 . Zníženie afinity Hb k O 2 prispieva k efektívnejšiemu uvoľňovaniu O 2 do tkaniva.
V pľúcach pri vysokom parciálnom tlaku kyslík interaguje s Hb a spája sa s hémovým železom; v tomto prípade sa zmení konformácia proteínu, centrálna dutina sa zníži a 2,3-BPG sa vytlačí z alosterického centra
Oligomérne proteíny majú teda v porovnaní s monomérnymi proteínmi nové vlastnosti. pripojenie ligandov na miestach,
priestorovo vzdialené od seba (alosterické), schopné spôsobiť konformačné zmeny v celej molekule proteínu. V dôsledku interakcie s regulačnými ligandami sa mení konformácia a funkcia molekuly proteínu sa prispôsobuje zmenám prostredia.
TÉMA 1.5. UDRŽOVANIE NATÍVNEJ KONFORMÁCIE PROTEÍNOV V PODMIENKACH BUNIEK
V bunkách, počas syntézy polypeptidových reťazcov, ich transport cez membrány do zodpovedajúcich častí bunky, v procese skladania (tvorba natívnej konformácie) a počas zostavovania oligomérnych proteínov, ako aj počas ich fungovania, medziprodukty V proteínovej štruktúre vznikajú nestabilné konformácie náchylné na agregáciu. Hydrofóbne radikály, zvyčajne skryté vo vnútri molekuly proteínu v ich natívnej konformácii, sa objavujú na povrchu v nestabilnej konformácii a majú tendenciu spájať sa so skupinami iných proteínov, ktoré sú podobne zle rozpustné vo vode. V bunkách všetkých známych organizmov boli nájdené špeciálne proteíny, ktoré zabezpečujú optimálne skladanie bunkových proteínov, stabilizujú ich prirodzenú konformáciu počas fungovania a čo je najdôležitejšie, udržujú štruktúru a funkcie intracelulárnych proteínov v prípade narušenia homeostázy. Tieto proteíny sa nazývajú "služobníci"čo vo francúzštine znamená „chůva“.
1. Molekulárne chaperóny a ich úloha v prevencii denaturácie bielkovín.
Chaperóny (III) sú klasifikované podľa hmotnosti podjednotiek. Chaperóny s vysokou molekulovou hmotnosťou majú hmotnosť 60 až 110 kD. Spomedzi nich boli najviac študované tri triedy: Sh-60, Sh-70 a Sh-90. Každá trieda zahŕňa rodinu príbuzných proteínov. Sh-70 teda obsahuje proteíny s molekulovou hmotnosťou 66 až 78 kD. Chaperóny s nízkou molekulovou hmotnosťou majú molekulovú hmotnosť 40 až 15 kD.
Medzi sprievodcami sú konštitutívny proteíny, ktorých vysoká bazálna syntéza nezávisí od stresujúcich účinkov na bunky tela, a indukovateľný, ktorých syntéza za normálnych podmienok je slabá, ale pri stresových vplyvoch sa prudko zvyšuje. Indukovateľné chaperóny sa tiež nazývajú „proteíny tepelného šoku“, pretože boli prvýkrát objavené v bunkách vystavených vysokým teplotám. V bunkách je v dôsledku vysokej koncentrácie proteínov ťažká spontánna regenerácia čiastočne denaturovaných proteínov. Sh-70 môže zabrániť procesu denaturácie, ktorý sa začal, a pomôcť obnoviť prirodzenú konformáciu proteínov. Molekulárne chaperóny-70- vysoko konzervovaná trieda proteínov, ktorá sa nachádza vo všetkých častiach bunky: cytoplazma, jadro, endoplazmatické retikulum, mitochondrie. Na karboxylovom konci jediného polypeptidového reťazca Sh-70 je oblasť, ktorá je drážkou, ktorá môže interagovať s peptidmi dĺžky
od 7 do 9 aminokyselinových zvyškov obohatených o hydrofóbne radikály. Takéto miesta v globulárnych proteínoch sa vyskytujú približne každých 16 aminokyselín. Sh-70 sú schopné chrániť proteíny pred tepelnou inaktiváciou a obnoviť konformáciu a aktivitu čiastočne denaturovaných proteínov.
2. Úloha chaperónov pri skladaní proteínov. Počas syntézy proteínov na ribozóme sa N-koncová oblasť polypeptidu syntetizuje pred C-koncovou oblasťou. Na vytvorenie natívnej konformácie je potrebná úplná aminokyselinová sekvencia proteínu. V procese syntézy proteínov sú chaperóny-70 vďaka štruktúre svojho aktívneho centra schopné pokryť miesta polypeptidu náchylné na agregáciu obohatené o hydrofóbne aminokyselinové radikály, kým sa syntéza nedokončí (obrázok 1.27, A).
 Ryža. 1.27. Zapojenie chaperónov do skladania proteínov
Ryža. 1.27. Zapojenie chaperónov do skladania proteínov
A - účasť chaperónov-70 pri prevencii hydrofóbnych interakcií medzi miestami syntetizovaného polypeptidu; B - tvorba natívnej proteínovej konformácie v chaperónovom komplexe
Mnoho vysokomolekulárnych proteínov s komplexnou konformáciou, ako je doménová štruktúra, sa skladá v špeciálnom priestore tvorenom W-60. Sh-60 funguje ako oligomérny komplex pozostávajúci zo 14 podjednotiek. Tvoria dva duté krúžky, z ktorých každý pozostáva zo siedmich podjednotiek, tieto krúžky sú navzájom spojené. Každá podjednotka III-60 pozostáva z troch domén: apikálnej (apikálnej), obohatenej o hydrofóbne radikály smerujúce do dutiny kruhu, intermediárnej a ekvatoriálnej (obr. 1.28).
 Ryža. 1.28. Štruktúra chaperonínového komplexu pozostávajúceho z 14 Sh-60
Ryža. 1.28. Štruktúra chaperonínového komplexu pozostávajúceho z 14 Sh-60
A - bočný pohľad; B - pohľad zhora
Syntetizované proteíny s povrchovými prvkami charakteristickými pre nezložené molekuly, najmä hydrofóbne radikály, vstupujú do dutiny chaperónových kruhov. V špecifickom prostredí týchto dutín prebieha enumerácia možných konformácií, kým sa nenájde jediná, energeticky najpriaznivejšia (obr. 1.27, B). Tvorba konformácií a uvoľňovanie proteínu je sprevádzané hydrolýzou ATP v rovníkovej oblasti. Typicky takéto skladanie závislé od chaperónu vyžaduje značné množstvo energie.
Okrem toho, že sa chaperóny podieľajú na tvorbe trojrozmernej štruktúry proteínov a renativácii čiastočne denaturovaných proteínov, sú nevyhnutné aj pre také základné procesy, ako je zostavovanie oligomérnych proteínov, rozpoznávanie a transport denaturovaných proteínov do lyzozómov, transport proteínov. cez membrány a účasť na regulácii aktivity proteínových komplexov.
TÉMA 1.6. RÔZNOSŤ PROTEÍNOV. PROTEÍNOVÉ RODINY NA PRÍKLADE IMUNOGLOBULÍNOV
1. Proteíny hrajú rozhodujúcu úlohu v živote jednotlivých buniek i celého mnohobunkového organizmu a ich funkcie sú prekvapivo rôznorodé. To je určené zvláštnosťami primárnej štruktúry a konformácií proteínov, jedinečnou štruktúrou aktívneho centra a schopnosťou viazať špecifické ligandy.
Len veľmi malá časť všetkých možných variantov peptidových reťazcov môže prijať stabilnú priestorovú štruktúru; väčšina
z nich môžu nadobudnúť mnoho konformácií s približne rovnakou Gibbsovou energiou, ale s rôznymi vlastnosťami. Primárna štruktúra väčšiny známych proteínov, vybraná biologickou evolúciou, poskytuje výnimočnú stabilitu jednej z konformácií, ktorá určuje vlastnosti fungovania tohto proteínu.
2. Proteínové rodiny. V rámci rovnakého biologického druhu môžu substitúcie aminokyselinových zvyškov viesť k vzniku rôznych proteínov, ktoré vykonávajú súvisiace funkcie a majú homológne aminokyselinové sekvencie. Takéto príbuzné proteíny majú nápadne podobné konformácie: počet a usporiadanie a-helixov a/alebo p-štruktúr a väčšina závitov a záhybov polypeptidových reťazcov je podobná alebo identická. Proteíny s homológnymi oblasťami polypeptidového reťazca, podobnou konformáciou a príbuznými funkciami sú izolované do proteínových rodín. Príklady rodín proteínov: serínové proteinázy, rodina imunoglobulínov, rodina myoglobínov.
Serínové proteinázy- rodina bielkovín, ktoré plnia funkciu proteolytických enzýmov. Patria sem tráviace enzýmy – chymotrypsín, trypsín, elastáza a mnohé faktory zrážania krvi. Tieto proteíny majú zo 40 % identické aminokyseliny a veľmi podobnú konformáciu (obr. 1.29).

Ryža. 1.29. Priestorové štruktúry elastázy (A) a chymotrypsínu (B)
Niektoré substitúcie aminokyselín viedli k zmene substrátovej špecifickosti týchto proteínov a k vzniku funkčnej diverzity v rámci rodiny.
3. Rodina imunoglobulínov. Proteíny imunoglobulínovej superrodiny, ktorá zahŕňa tri proteínové rodiny, hrajú obrovskú úlohu vo fungovaní imunitného systému:
Protilátky (imunoglobulíny);
receptory T-lymfocytov;
Proteíny hlavného histokompatibilného komplexu - MHC 1. a 2. triedy (Major Histocompatibility Complex).
Všetky tieto proteíny majú doménovú štruktúru, pozostávajú z homológnych domén podobných imunite a vykonávajú podobné funkcie: interagujú s cudzími štruktúrami, buď rozpustenými v krvi, lymfe alebo medzibunkovej tekutine (protilátky), alebo umiestnenými na povrchu buniek (vlastné resp. zahraničné).
4. Protilátky- špecifické bielkoviny produkované B-lymfocytmi ako odpoveď na požitie cudzej štruktúry tzv antigén.
Vlastnosti štruktúry protilátok
Najjednoduchšie protilátkové molekuly pozostávajú zo štyroch polypeptidových reťazcov: dvoch identických ľahkých reťazcov – L, obsahujúcich približne 220 aminokyselín, a dvoch identických ťažkých reťazcov – H, pozostávajúcich zo 440-700 aminokyselín. Všetky štyri reťazce v molekule protilátky sú spojené mnohými nekovalentnými väzbami a štyrmi disulfidovými väzbami (obr. 1.30).
Ľahké reťazce protilátok pozostávajú z dvoch domén: variabilnej (VL), umiestnenej v N-koncovej oblasti polypeptidového reťazca, a konštantnej (CL), umiestnenej na C-konci. Ťažké reťazce majú typicky štyri domény: jednu premennú (VH) na N-konci a tri konštanty (CH1, CH2, CH3) (pozri obrázok 1.30). Každá imunoglobulínová doména má β-skladanú nadstavbu, v ktorej sú dva cysteínové zvyšky spojené disulfidovou väzbou.
Medzi dvoma konštantnými doménami CH1 a CH2 je oblasť obsahujúca veľké množstvo prolínových zvyškov, ktoré bránia vytvoreniu sekundárnej štruktúry a interakcii susedných H-reťazcov v tomto segmente. Táto pántová oblasť poskytuje molekule protilátky flexibilitu. Medzi variabilnými doménami ťažkého a ľahkého reťazca sú dve identické miesta viažuce antigén (aktívne miesta pre väzbu antigénov), preto sa takéto protilátky často nazývajú bivalenty. Väzba antigénu na protilátku nezahŕňa celú aminokyselinovú sekvenciu variabilných oblastí oboch reťazcov, ale iba 20-30 aminokyselín umiestnených v hypervariabilných oblastiach každého reťazca. Práve tieto oblasti určujú jedinečnú schopnosť každého typu protilátky interagovať so zodpovedajúcim komplementárnym antigénom.
Protilátky sú jednou z obranných línií tela proti invázii cudzích organizmov. Ich fungovanie možno rozdeliť do dvoch etáp: prvým stupňom je rozpoznanie a naviazanie antigénu na povrch cudzích organizmov, čo je možné vďaka prítomnosti miest viažucich antigén v štruktúre protilátky; druhým stupňom je spustenie procesu inaktivácie a deštrukcie antigénu. Špecifickosť druhého štádia závisí od triedy protilátok. Existuje päť tried ťažkých reťazcov, ktoré sa navzájom líšia štruktúrou konštantných domén: α, δ, ε, γ a μ, podľa ktorých sa rozlišuje päť tried imunoglobulínov: A, D, E, G a M.
Štrukturálne znaky ťažkých reťazcov dávajú pántovým oblastiam a C-koncovým oblastiam ťažkých reťazcov konformáciu charakteristickú pre každú triedu. Akonáhle sa antigén naviaže na protilátku, konformačné zmeny v konštantných doménach určujú cestu na odstránenie antigénu.
 Ryža. 1. 30. Štruktúra domény IgG
Ryža. 1. 30. Štruktúra domény IgG
Imunoglobulíny M
Imunoglobulíny M majú dve formy.
Monomérna forma- 1. trieda protilátok produkovaných vyvíjajúcim sa B-lymfocytom. Následne mnohé B bunky prejdú na produkciu iných tried protilátok, ale s rovnakým väzbovým miestom pre antigén. IgM je začlenený do membrány a pôsobí ako receptor rozpoznávajúci antigén. Inkorporácia IgM do bunkovej membrány je možná vďaka prítomnosti 25 hydrofóbnych aminokyselinových zvyškov v chvostovej časti oblasti.
Sekrečná forma IgM obsahuje päť monomérnych podjednotiek spojených navzájom disulfidovými väzbami a ďalší polypeptidový J-reťazec (obr. 1.31). Monoméry s ťažkým reťazcom tejto formy neobsahujú hydrofóbny koniec. Pentamér má 10 miest viažucich antigén, a preto je účinný pri rozpoznávaní a odstraňovaní antigénu, ktorý sa dostal do tela prvýkrát. Sekrečná forma IgM je hlavnou triedou protilátok vylučovaných do krvi počas primárnej imunitnej odpovede. Väzba IgM na antigén mení konformáciu IgM a vyvoláva jeho väzbu na prvú proteínovú zložku systému komplementu (systém komplementu je súbor proteínov podieľajúcich sa na deštrukcii antigénu) a aktiváciu tohto systému. Ak sa antigén nachádza na povrchu mikroorganizmu, komplementový systém spôsobuje narušenie integrity bunková membrána a smrť bakteriálnej bunky.
Imunoglobulíny G
Z kvantitatívneho hľadiska táto trieda imunoglobulínov prevláda v krvi (75 % všetkých Ig). IgG - monoméry, hlavná trieda protilátok vylučovaných do krvi počas sekundárnej imunitnej odpovede. Po interakcii IgG s povrchovými antigénmi mikroorganizmov je komplex antigén-protilátka schopný viazať a aktivovať proteíny komplementového systému alebo môže interagovať so špecifickými receptormi na makrofágoch a neutrofiloch. interakcia s fagocytmi
 Ryža. 1.31. Štruktúra sekrečnej formy IgM
Ryža. 1.31. Štruktúra sekrečnej formy IgM
k absorpcii komplexov antigén-protilátka a ich deštrukcii vo fagozómoch buniek. IgG je jediná trieda protilátok, ktoré môžu prechádzať placentárnou bariérou a chrániť plod pred infekciami v maternici.
Imunoglobulíny A
Hlavná trieda protilátok prítomných v sekrétoch (mlieko, sliny, respiračné a črevné sekréty). IgA sa vylučuje hlavne v dimérnej forme, kde sú monoméry navzájom spojené prostredníctvom ďalšieho J-reťazca (obr. 1.32).
IgA neinteragujú so systémom komplementu a fagocytárnymi bunkami, ale väzbou na mikroorganizmy im protilátky bránia prichytiť sa na epitelové bunky a preniknúť do tela.
Imunoglobulíny E
Imunoglobulíny E sú reprezentované monomérmi, v ktorých ťažké ε-reťazce obsahujú, rovnako ako μ-reťazce imunoglobulínov M, jednu variabilnú a štyri konštantné domény. IgE sa po sekrécii viažu na svoje vlastné
 Ryža. 1.32. Štruktúra IgA
Ryža. 1.32. Štruktúra IgA
C-koncové oblasti so zodpovedajúcimi receptormi na povrchu žírnych buniek a bazofilov. Tým sa stávajú receptormi pre antigény na povrchu týchto buniek (obr. 1.33).
 Ryža. 1.33. Interakcia IgE s antigénom na povrchu žírnej bunky
Ryža. 1.33. Interakcia IgE s antigénom na povrchu žírnej bunky
Po naviazaní antigénu na zodpovedajúce miesta IgE viažuce antigén bunky dostanú signál na sekréciu biologicky aktívnych látok (histamín, serotonín), ktoré sú do značnej miery zodpovedné za rozvoj zápalovej reakcie a za prejavy takých alergických reakcií, ako sú napr. astma, žihľavka, senná nádcha.
Imunoglobulíny D
Imunoglobulíny D sa nachádzajú v sére vo veľmi malých množstvách, sú to monoméry. Ťažké 5 reťazce majú jednu variabilnú a tri konštantné domény. IgD pôsobia ako receptory pre B-lymfocyty, ďalšie funkcie sú zatiaľ neznáme. Interakcia špecifických antigénov s receptormi na povrchu B-lymfocytov (IgD) vedie k prenosu týchto signálov do bunky a aktivácii mechanizmov, ktoré zabezpečujú reprodukciu tohto klonu lymfocytov.
TÉMA 1.7. FYZIKÁLNO-CHEMICKÉ VLASTNOSTI PROTEÍNOV A METÓDY ICH SEPARÁCIE
1. Jednotlivé proteíny sa líšia svojimi fyzikálno-chemickými vlastnosťami:
tvar molekúl;
Molekulová hmotnosť;
Celkový náboj, ktorého hodnota závisí od pomeru aniónových a katiónových skupín aminokyselín;
Pomer polárnych a nepolárnych aminokyselinových radikálov na povrchu molekúl;
Stupne odolnosti voči rôznym denaturačným činidlám.
2. Rozpustnosť proteínov závisí na vlastnostiach proteínov uvedených vyššie, ako aj na zložení média, v ktorom sa proteín rozpúšťa (hodnoty pH, zloženie solí, teplota, prítomnosť iných organických látok, ktoré môžu interagovať s proteínom). Veľkosť náboja proteínových molekúl je jedným z faktorov ovplyvňujúcich ich rozpustnosť. Keď sa náboj v izoelektrickom bode stratí, proteíny ľahšie agregujú a precipitujú. To platí najmä pre denaturované proteíny, ktoré majú na povrchu hydrofóbne aminokyselinové radikály.
Na povrchu molekuly proteínu sú pozitívne aj negatívne nabité aminokyselinové radikály. Počet týchto skupín a tým aj celkový náboj proteínov závisí od pH média, t.j. pomer koncentrácie H + - a OH - skupín. V kyslom prostredí zvýšenie koncentrácie H+ vedie k potlačeniu disociácie karboxylových skupín -COO - + H+ > -COOH a zníženiu negatívneho náboja bielkovín. V alkalickom prostredí vedie väzba prebytočných OH - protónov vzniknutých pri disociácii aminoskupín -NH 3 + + OH - - NH 2 + H 2 O za vzniku vody k zníženiu kladného náboja bielkovín. Hodnota pH, pri ktorej má proteín čistý náboj nula, sa nazýva izoelektrický bod (IEP). V IET je počet kladne a záporne nabitých skupín rovnaký, t.j. proteín je v izoelektrickom stave.
3. Separácia jednotlivých bielkovín. Vlastnosti štruktúry a fungovania tela závisia od súboru proteínov syntetizovaných v ňom. Štúdium štruktúry a vlastností proteínov nie je možné bez ich izolácie z bunky a čistenia od iných proteínov a organických molekúl. Etapy izolácie a purifikácie jednotlivých proteínov:
zničenie buniekštudovaného tkaniva a získanie homogenátu.
Rozdelenie homogenátu na frakcie centrifugáciou, získaním jadrovej, mitochondriálnej, cytosolickej alebo inej frakcie obsahujúcej požadovaný proteín.
Selektívna tepelná denaturácia- krátkodobé zahrievanie proteínového roztoku, pri ktorom sa môže odstrániť časť denaturovaných proteínových nečistôt (v prípade, že je proteín relatívne tepelne stabilný).
Vysolenie. Rôzne proteíny sa zrážajú pri rôznych koncentráciách soli v roztoku. Postupným zvyšovaním koncentrácie soli je možné získať množstvo jednotlivých frakcií s prevažujúcim obsahom secernovaného proteínu v jednej z nich. Najčastejšie používanou frakcionáciou proteínov je síran amónny. Proteíny s najnižšou rozpustnosťou sa zrážajú pri nízkych koncentráciách solí.
Gélová filtrácia- metóda preosievania molekúl cez napučané granule Sephadexu (trojrozmerné dextránové polysacharidové reťazce s pórmi). Rýchlosť prechodu proteínov cez kolónu naplnenú Sephadexom bude závisieť od ich molekulovej hmotnosti: čím menšia je hmotnosť proteínových molekúl, tým ľahšie preniknú do granúl a zostanú tam dlhšie, čím väčšia je hmotnosť, tým rýchlejšie sa vymyjú z granúl. stĺpec.
Ultracentrifugácia- metóda spočívajúca v tom, že proteíny v centrifugačnej skúmavke sú umiestnené v rotore ultracentrifúgy. Keď sa rotor otáča, rýchlosť sedimentácie proteínov je úmerná ich molekulovej hmotnosti: frakcie ťažších proteínov sú umiestnené bližšie ku dnu skúmavky, ľahšie sú bližšie k povrchu.
elektroforéza- metóda založená na rozdieloch v rýchlosti pohybu bielkovín v elektrickom poli. Táto hodnota je úmerná náboju bielkovín. Elektroforéza proteínov sa vykonáva na papieri (v tomto prípade je rýchlosť pohybu proteínov úmerná iba ich náboju) alebo v polyakrylamidovom géli s určitou veľkosťou pórov (rýchlosť pohybu proteínov je úmerná ich náboju a molekulovej hmotnosti). ).
Iónovo výmenná chromatografia- frakcionačná metóda založená na väzbe ionizovaných skupín bielkovín s opačne nabitými skupinami iónomeničových živíc (nerozpustné polymérne materiály). Sila väzby proteínu na živicu je úmerná náboju proteínu. Proteíny adsorbované na iónomeničovom polyméri sa môžu zmyť so zvyšujúcou sa koncentráciou roztokov NaCl; čím nižší je náboj proteínu, tým nižšia koncentrácia NaCl bude potrebná na vymytie proteínu spojeného s iónovými skupinami živice.
Afinitná chromatografia- najšpecifickejšia metóda izolácie jednotlivých proteínov Ligand proteínu je kovalentne naviazaný na inertný polymér. Keď proteínový roztok prechádza kolónou s polymérom, v dôsledku komplementárnej väzby proteínu na ligand sa na kolóne adsorbuje iba proteín špecifický pre tento ligand.
Dialýza- metóda používaná na odstránenie zlúčenín s nízkou molekulovou hmotnosťou z roztoku izolovaného proteínu. Metóda je založená na neschopnosti proteínov prejsť cez semipermeabilnú membránu, na rozdiel od látok s nízkou molekulovou hmotnosťou. Používa sa na čistenie bielkovín od nečistôt s nízkou molekulovou hmotnosťou, napríklad od solí po vysolení.
ÚLOHY NA MIMO ŠKOLSTVO
1. Vyplňte tabuľku. 1.4.
Tabuľka 1.4. Porovnávacia analýzaštruktúry a funkcie príbuzných proteínov – myoglobínu a hemoglobínu
a) zapamätať si štruktúru aktívneho centra Mb a Hb. Akú úlohu zohrávajú hydrofóbne radikály aminokyselín pri tvorbe aktívnych centier týchto proteínov? Popíšte štruktúru aktívneho centra Mb a Hb a mechanizmy naviazania ligandu naň. Akú úlohu hrajú jeho zvyšky F8 a His E7 vo fungovaní aktívnych miest Mv a Hv?
b) aké nové vlastnosti v porovnaní s monomérnym myoglobínom má blízko príbuzný oligomérny proteín hemoglobín? Vysvetlite úlohu kooperatívnych zmien v konformácii protomérov v molekule hemoglobínu, vplyv koncentrácií CO 2 a protónov na afinitu hemoglobínu ku kyslíku a úlohu 2,3-BPG v alosterickej regulácii funkcie Hb.
2. Opíšte vlastnosti molekulárnych chaperónov, pričom venujte pozornosť vzťahu medzi ich štruktúrou a funkciou.
3. Aké proteíny sú zoskupené do rodín? Na príklade rodiny imunoglobulínov určte podobné štruktúrne znaky a súvisiace funkcie proteínov tejto rodiny.
4. Na biochemické a medicínske účely sú často potrebné purifikované jednotlivé proteíny. Vysvetlite, na akých fyzikálno-chemických vlastnostiach bielkovín sú založené metódy používané na ich separáciu a čistenie.
ÚLOHY PRE SEBAOVLÁDANIE
1. Vyberte správne odpovede.
Funkcie hemoglobínu:
A. Transport O 2 z pľúc do tkanív B. Transport H + z tkanív do pľúc
B. Udržiavanie konštantného pH krvi D. Transport CO2 z pľúc do tkanív
D. Transport CO 2 z tkanív do pľúc
2. Vyberte správne odpovede. ligandα -Hb protomér je: A. Heme
B. Kyslík
B. CO D. 2,3-BPG
D. P-Protomér
3. Vyberte správne odpovede.
Hemoglobín sa líši od myoglobínu:
A. Má kvartérnu štruktúru
B. Sekundárnu štruktúru predstavujú len α-helixy
B. Vzťahuje sa na komplexné proteíny
D. Interaguje s alosterickým ligandom D. Kovalentne viazaný na hem
4. Vyberte správne odpovede.
Afinita Hb k O2 klesá:
A. Keď je pripojená jedna molekula O 2 B. Keď je jedna molekula O 2 eliminovaná
B. Pri interakcii s 2,3-BPG
D. Keď je pripojený k protomérom H + D. Keď koncentrácia 2,3-BPG klesá
5. Nastavte zhodu.
Pre typy Hb je charakteristické:
A. Vytvára fibrilárne agregáty v deoxy forme B. Obsahuje dva α- a dva δ-reťazce
B. Prevládajúca forma Hb v dospelých erytrocytoch D. Obsahuje hém s Fe + 3 v aktívnom centre
D. Obsahuje dva α- a dva γ-reťazce 1. HvA 2.
6. Nastavte zhodu.
Ligandy Hb:
A. Viaže sa na Hb v alosterickom centre
B. Má veľmi vysokú afinitu k aktívnemu miestu Hb
B. Spájanie zvyšuje afinitu Hb k O 2 D. Oxiduje Fe + 2 až Fe + 3
D. Vytvára kovalentnú väzbu s hysF8
7. Vyberte správne odpovede.
Sprievodcovia:
A. Proteíny prítomné vo všetkých častiach bunky
B. Syntéza sa zvyšuje pod vplyvom stresu
B. Podieľať sa na hydrolýze denaturovaných bielkovín
D. Podieľať sa na udržiavaní prirodzenej konformácie proteínov
D. Vytvorte organely, v ktorých sa tvorí proteínová konformácia
8. Zápas. Imunoglobulíny:
A. Sekrečná forma je pentamérna
B. Ig trieda, ktorá prechádza placentárnou bariérou
B. Ig - receptor mastocytov
D. Hlavná trieda Ig prítomná v sekrétoch epitelových buniek. D. B-lymfocytový receptor, ktorého aktivácia zabezpečuje reprodukciu buniek
9. Vyberte správne odpovede.
Imunoglobulíny E:
A. Produkované makrofágmi B. Majú ťažké ε-reťazce.
B. Vložené do membrány T-lymfocytov
D. Pôsobia ako membránové receptory pre antigény na žírnych bunkách a bazofiloch
D. Zodpovedný za prejav alergických reakcií
10. Vyberte správne odpovede.
Metóda separácie proteínov je založená na rozdieloch v ich molekulovej hmotnosti:
A. Gélová filtrácia
B. Ultracentrifugácia
B. Elektroforéza na polyakrylamidovom géli D. Chromatografia na výmene iónov
D. Afinitná chromatografia
11. Vyber správnu odpoveď.
Metóda separácie proteínov je založená na rozdieloch v ich rozpustnosti vo vode:
A. Gélová filtrácia B. Vysolenie
B. Ionexová chromatografia D. Afinitná chromatografia
E. Elektroforéza na polyakrylamidovom géli
ŠTANDARDY ODPOVEDÍ NA „ÚLOHY PRE SEBAOVLÁDANIE“
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-D
6. 1-C, 2-B, 3-A
7. A, B, D, D
8,1-G; 2-B, 3-C
ZÁKLADNÉ POJMY A POJMY
1. Oligomérne proteíny, protomér, kvartérna štruktúra proteínov
2. Kooperatívne zmeny v konformácii protoméru
3. Bohrov efekt
4. Alosterická regulácia funkcií proteínov, alosterické centrum a alosterický efektor
5. Molekulárne chaperóny, proteíny tepelného šoku
6. Proteínové rodiny (serínové proteázy, imunoglobulíny)
7. IgM-, G-, E-, A-spojenie štruktúry s funkciou
8. Celkový náboj bielkovín, izoelektrický bod bielkovín
9. Elektroforéza
10. Vysolenie
11. Gélová filtrácia
12. Ionexová chromatografia
13. Ultracentrifugácia
14. Afinitná chromatografia
15. Elektroforéza plazmatických bielkovín
ÚLOHY PRE AUDITORSKÚ PRÁCU
1. Porovnajte závislosti stupňov nasýtenia hemoglobínu (Hb) a myoglobínu (Mb) kyslíkom od jeho parciálneho tlaku v tkanivách
 Ryža. 1.34. Saturačná závislosť MV aHbkyslík z jeho parciálneho tlaku
Ryža. 1.34. Saturačná závislosť MV aHbkyslík z jeho parciálneho tlaku
Upozorňujeme, že tvar kriviek nasýtenia proteínu kyslíkom je odlišný: pre myoglobín - hyperbola, pre hemoglobín - sigmoidný tvar.
1. Porovnajte hodnoty parciálneho tlaku kyslíka, pri ktorom sú Mb a Hb nasýtené O 2 na 50 %. Ktorý z týchto proteínov má vyššiu afinitu k O 2 ?
2. Aké štrukturálne vlastnosti MB určujú jeho vysokú afinitu k O 2 ?
3. Aké štrukturálne vlastnosti Hb umožňujú uvoľňovať O 2 v kapilárach pokojových tkanív (pri relatívne vysokom parciálnom tlaku O 2) a prudko zvyšovať tento návrat v pracujúcich svaloch? Aká vlastnosť oligomérnych proteínov poskytuje tento účinok?
4. Vypočítajte, aké množstvo O 2 (v %) dodáva okysličený hemoglobín odpočívajúcemu a pracujúcemu svalu?
5. vyvodiť závery o vzťahu medzi štruktúrou proteínu a jeho funkciou.
2. Množstvo kyslíka uvoľneného hemoglobínom v kapilárach závisí od intenzity katabolických procesov v tkanivách (Bohrov efekt). Ako zmeny v tkanivovom metabolizme regulujú afinitu Hb k O 2 ? Vplyv CO 2 a H+ na afinitu Hb k O 2
 1. Popíšte Bohrov efekt.
1. Popíšte Bohrov efekt.
2. akým smerom prebieha proces znázornený v diagrame:
a) v kapilárach pľúc;
b) v tkanivových kapilárach?
3. Aký je fyziologický význam Bohrovho efektu?
4. Prečo interakcia Hb s H+ v miestach vzdialených od hemu mení afinitu proteínu k O 2 ?
3. Afinita Hb k O 2 závisí od koncentrácie jeho ligandu, 2,3-bifosfoglycerátu, ktorý je alosterickým regulátorom afinity Hb k O 2 . Prečo interakcia ligandu v mieste vzdialenom od aktívneho miesta ovplyvňuje funkciu proteínu? Ako 2,3-BPG reguluje afinitu Hb k O 2 ? Ak chcete problém vyriešiť, odpovedzte na nasledujúce otázky:
1. Kde a z čoho sa syntetizuje 2,3-bifosfoglycerát (2,3-BPG)? Napíšte jej vzorec, uveďte náboj tejto molekuly.
2. S akou formou hemoglobínu (oxy alebo deoxy) interaguje BPG a prečo? V ktorej oblasti molekuly Hb prebieha interakcia?
3. akým smerom prebieha proces znázornený na diagrame?
a) v tkanivových kapilárach;
b) v kapilárach pľúc?
4. kde by malo byť viac vysoká koncentrácia komplexné
Nv-2,3-BFG:
a) v kľudových kapilárach svalov,
b) v kapilárach pracujúcich svalov (za predpokladu rovnakej koncentrácie BPG v erytrocytoch)?
5. Ako sa zmení afinita Hb ku kyslíku, keď sa človek prispôsobí podmienkam vysokej nadmorskej výšky, ak sa zvýši koncentrácia BPG v erytrocytoch? Aký je fyziologický význam tohto javu?
4. Deštrukcia 2,3-BPG počas skladovania konzervovanej krvi narúša funkcie Hb. Ako sa zmení afinita Hb k O 2 v zachovanej krvi, ak koncentrácia 2,3-BPG v erytrocytoch môže klesnúť z 8 na 0,5 mmol/l. Je možné podať takúto krv ťažko chorým pacientom, ak sa koncentrácia 2,3-BPG obnoví najskôr po troch dňoch? Je možné obnoviť funkcie erytrocytov pridaním 2,3-BPG do krvi?
5. Spomeňte si na štruktúru najjednoduchších molekúl imunoglobulínu. Akú úlohu zohrávajú imunoglobulíny v imunitnom systéme? Prečo sa Ig často označujú ako bivalentné? Ako súvisí štruktúra Ig s ich funkciou? (Opíšte pomocou príkladu triedy imunoglobulínov.)
Fyzikálno-chemické vlastnosti bielkovín a metódy ich separácie.
6. Ako čistý náboj proteínu ovplyvňuje jeho rozpustnosť?
a) Stanovte celkový náboj peptidu pri pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) ako sa zmení náboj tohto peptidu pri pH >7, pH<7, рН <<7?
c) aký je izoelektrický bod proteínu (IEP) a v akom prostredí leží
IET tohto peptidu?
d) pri akej hodnote pH bude pozorovaná najmenšia rozpustnosť tohto peptidu.
7. Prečo sa kyslé mlieko pri varení na rozdiel od čerstvého mlieka „zráža“ (t. j. kazeínová mliečna bielkovina sa vyzráža)? Molekuly kazeínu v čerstvom mlieku majú záporný náboj.
8. Na oddelenie jednotlivých bielkovín sa používa gélová filtrácia. Zmes obsahujúca proteíny A, B, C s molekulovými hmotnosťami 160 000, 80 000 a 60 000 sa analyzovala gélovou filtráciou (obr. 1.35). Napučané gélové granule sú priepustné pre bielkoviny s molekulovou hmotnosťou menšou ako 70 000. Na akom princípe je založená táto separačná metóda? Ktorý z grafov správne znázorňuje výsledky frakcionácie? Uveďte poradie uvoľňovania proteínov A, B a C z kolóny.
 Ryža. 1.35. Použitie metódy gélovej filtrácie na separáciu proteínov
Ryža. 1.35. Použitie metódy gélovej filtrácie na separáciu proteínov
9. Na obr. 1.36, A ukazuje diagram elektroforézy na papieri proteínov v krvnom sére zdravého človeka. Relatívne množstvá proteínových frakcií získaných touto metódou sú: albumíny 54-58 %, ai-globulíny 6-7 %, a2-globulíny 8-9 %, β-globulíny 13 %, y-globulíny 11-12 %.
 Ryža. 1.36 Elektroforéza na papieri bielkovín krvnej plazmy zdravého človeka (A) a pacienta (B)
Ryža. 1.36 Elektroforéza na papieri bielkovín krvnej plazmy zdravého človeka (A) a pacienta (B)
I - y-globulíny; II - β-globulíny; III -α 2 - globulín; IV-α 2 - globulín; V - albumíny
Mnohé ochorenia sú sprevádzané kvantitatívnymi zmenami v zložení srvátkových bielkovín (dysproteinémia). Povaha týchto zmien sa berie do úvahy pri stanovení diagnózy a hodnotení závažnosti a štádia ochorenia.
Pomocou údajov uvedených v tabuľke. 1.5, urobte predpoklad o chorobe, ktorá je charakterizovaná elektroforetickým profilom znázorneným na obr. 1.36.
Tabuľka 1.5. Zmeny koncentrácie proteínov v krvnom sére v patológii
Biochémia- Toto je veda o molekulárnych základoch života, zaoberá sa štúdiom molekúl, chemických reakcií, procesov prebiehajúcich v živých bunkách tela. Rozdelené na:
statické (štruktúra a vlastnosti biomolekúl)
dynamický (chémia reakcií)
špeciálne sekcie (životné prostredie, biochémia mikroorganizmov, klinické)
Úloha biochémie pri riešení základných medicínskych problémov
zachovanie ľudského zdravia
zisťovanie príčin rôznych ochorení a hľadanie spôsobov, ako ich efektívne liečiť.
Akákoľvek nevoľnosť, ľudské ochorenie je teda spojené s porušením štruktúry a vlastností metabolitov alebo biomolekúl a je tiež spojené so zmenami v biochemických reakciách vyskytujúcich sa v tele. Použitie akýchkoľvek metód liečby, liekov je tiež založené na pochopení a presnom poznaní biochémie ich pôsobenia.
Proteíny, ich štruktúra a biologická úloha
Proteíny sú polypeptidy s vysokou molekulovou hmotnosťou, podmienená hranica medzi proteínmi a polypeptidmi je zvyčajne 8000-10000 jednotiek molekulovej hmotnosti. Polypeptidy sú polymérne zlúčeniny, ktoré majú viac ako 10 aminokyselinových zvyškov na molekulu.
Peptidy sú zlúčeniny pozostávajúce z dvoch alebo viacerých aminokyselinových zvyškov (až 10).Proteíny obsahujú iba L-aminokyseliny.
Existujú deriváty aminokyselín, napríklad kolagén obsahuje hydroxyprolín a hydroxylyzín. V niektorých proteínoch sa nachádza γ-karboxyglutamát. Porucha karboxylácie glutamátu v protrombíne môže viesť ku krvácaniu. Fosfoserín sa často nachádza v bielkovinách.
Esenciálne aminokyseliny sú tie, ktoré sa v tele nesyntetizujú resp
syntetizované v nedostatočnom množstve alebo v nízkej miere.
8 aminokyselín je pre človeka nevyhnutných: tryptofán, fenylalanín,
metionín, lyzín, valín, treonín, izoleucín, leucín.
Biochemické funkcie aminokyselín:
stavebné bloky peptidov, polypeptidov a proteínov,
biosyntéza iných aminokyselín (tyrozín je syntetizovaný z fenylalanínu, cysteín je syntetizovaný z metionínu)
biosyntéza určitých hormónov, napríklad oxytacínu, vazopresínu, inzulínu
počiatočné produkty na tvorbu glutatiónu, kreatínu
glycín je nevyhnutný pre syntézu porfyrínu
p - alanín, valín, cysteínová forma CoA, tryptofán - nikotínamid, kyselina glutámová - kyselina listová
biosyntéza nukleotidov vyžaduje glutamín, glycín, kyselinu asparágovú, tvoria purínové bázy, glutamín a kyselinu asparágovú - pyrimidín
11 aminokyselín je glukogénnych, čo znamená, že sa môžu metabolizovať na glukózu a iné sacharidy
fenylalanín, tyrozín, leucín, lyzín a tryptofán sa podieľajú na biosyntéze určitých lipidov
10. tvorba močoviny, oxidu uhličitého a energie vo forme ATP.
Štruktúra bielkovín. primárna štruktúra.
Pod primárnou štruktúrou rozumieme poradie aminokyselín v reťazci, ktoré sú vzájomne prepojené kovalentnými peptidovými väzbami. Polypeptidový reťazec začína zvyškom, ktorý má voľnú aminoskupinu (N - koniec) a končí voľným COOH - koncom.
Primárna štruktúra tiež zahŕňa interakciu medzi cysteínovými zvyškami s tvorbou disulfidových väzieb.
Primárna štruktúra je teda popisom všetkých kovalentných väzieb v molekule proteínu.
Peptidová väzba sa líši polaritou, čo je spôsobené tým, že väzba medzi N a C má čiastočne charakter dvojitej väzby. Rotácia je náročná a peptidová väzba má tuhú štruktúru. Poradie aminokyselín je prísne geneticky určené, určuje prirodzený charakter proteínu a jeho funkcie v tele.
sekundárna štruktúra
1951 - bola dešifrovaná sekundárna štruktúra (pevne stočený hlavný reťazec polypeptidu, ktorý tvorí vnútornú časť tyčinky, bočné reťazce smerujú von, usporiadané do špirály) Všetky -C=O-N-H- skupiny báz reťazce sú spojené vodíkovými väzbami.
Vodíkové väzby robia a-helix stabilnejším.
Ďalším typom sekundárnej štruktúry je p – skladaná vrstva. Ide o paralelné polypeptidové reťazce, ktoré sú zosieťované vodíkovými väzbami. Krútenie takýchto p-formácií je možné, čo dáva proteínu väčšiu silu.
Tretí typ sekundárnej štruktúry je charakteristický pre kolagén. Každý z troch polypeptidových reťazcov kolagénového prekurzora (tropokolagénu) je špirálovitý. Tri takéto špirálovité reťaze sú navzájom skrútené a tvoria pevnú niť.
Špecifickosť tohto typu štruktúry je spôsobená prítomnosťou vodíkových väzieb čisto medzi glycínovými, prolínovými a hydroxyprolínovými zvyškami, ako aj intra- a intermolekulárnych kovalentných krížových väzieb.
MINISTERSTVO KULTÚRY, ŠKOLSTVA A ZDRAVOTNÍCTVA
REPUBLIKA KAZACHSTAN
UNIVERZITA PAVLODAR
KATEDRA BIOLÓGIE
TEST
Predmet: "Biochémia"
Dokončené
Pavlodar, 2004
1. Voda v živých organizmoch. Štruktúra a vlastnosti vody.
2. Štruktúrne vzorce purínových a pyrimidínových báz, ktoré sú súčasťou nukleových kyselín.
3. Vlastnosti enzýmov, špecifickosť pôsobenia enzýmov. Rozdiely medzi denaturovaným proteínom a natívnym proteínom.
4. Vitamín D, vitamery tohto vitamínu. Známky beriberi D. Prírodné zdroje vitamínu D.
5. Schéma dichotomického rozkladu D-glukózy (glykolýza).
6. Štruktúrny vzorec peptid-valyl-izoleucyl-metionyl-argenin.
Všetky živé veci na našej planéte tvoria 2/3 vody. Mikroorganizmy sú na prvom mieste v živej hmote z hľadiska hmotnosti, rastliny sú na druhom, zvieratá sú na treťom a ľudia sú na poslednom. Baktérie na 81 percent. Tvorí ich voda, spóry – 50 percent, živočíšne tkanivo priemerne 70 percent, lymfa – 90 percent, krv obsahuje asi 79 percent. Najbohatším tkanivom na vodu je sklovec oka, ktorý obsahuje až 99 percent. vlhkosť, najchudobnejšia – zubná sklovina – len 0,2 percenta.
Voda v tele plní niekoľko funkcií: látky v nej rozpustené navzájom reagujú, voda pomáha odstraňovať metabolické splodiny, slúži ako regulátor teploty, je dobrým nosičom tepla a tiež lubrikantom.
V živých organizmoch môže byť voda syntetizovaná v tkanivách. Takže napríklad u ťavy môže tuk v hrbe, oxidovaný, poskytnúť až 40 litrov vody. Človek, ktorý vypije 2,5 litra vody denne, prepláchne žalúdok 10 litrami tekutín a odparí 0,7 litra vody.
Štúdium chemického zloženia buniek ukazuje, že v živých organizmoch neexistujú žiadne špeciálne chemické prvky, ktoré sú pre ne vlastné: práve v tom sa prejavuje jednota chemického zloženia živej a neživej prírody.
Úloha chemických prvkov v bunke je veľká: N a S sú súčasťou bielkovín, P je v DNA a RNA, Mg je súčasťou mnohých enzýmov a molekuly chlorofylu, Cu je súčasťou mnohých oxidačných enzýmov, Zn je pankreatický hormón, Fe je molekula hemoglobínu, I - hormón tyroxín atď. Pre bunku sú najdôležitejšie anióny HPO42-, H2RO4-, CO32-, Cl-, HCO3- a katióny Na +, K +, Ca2 +
Obsah katiónov a aniónov v bunke sa líši od ich koncentrácie v prostredí obklopujúcom bunku v dôsledku aktívnej regulácie prenosu látok membránou. To zabezpečuje stálosť chemického zloženia živej bunky. So smrťou buniek sa koncentrácia látok v médiu a v cytoplazme vyrovná. Z anorganických zlúčenín je dôležitá voda, minerálne soli, kyseliny a zásady.
Voda vo fungujúcej bunke zaberá až 80 % jej objemu a nachádza sa v nej v dvoch formách: voľná a viazaná. Molekuly viazanej vody sú pevne spojené s bielkovinami a vytvárajú okolo nich vodné škrupiny, ktoré navzájom izolujú bielkoviny. Polarita molekúl vody, schopnosť vytvárať vodíkové väzby vysvetľuje jej vysokú špecifickú tepelnú kapacitu. V dôsledku toho sa v živých systémoch zabráni prudkým výkyvom teploty a v bunke sa teplo distribuuje a uvoľňuje. Vďaka viazanej vode je článok schopný odolávať nízkym teplotám. Jeho obsah v bunke je približne 5% a 95% je voľná voda. Ten rozpúšťa mnohé látky zapojené v bunke do výmeny.
Vo vysoko aktívnych bunkách, ako je mozgové tkanivo, voda tvorí asi 85 % a vo svaloch viac ako 70 %; v menej aktívnych bunkách, ako je tukové tkanivo, tvorí voda asi 40 % jeho hmoty. V živých organizmoch voda nielenže rozpúšťa mnohé látky; s jeho účasťou dochádza k hydrolytickým reakciám - štiepeniu organických zlúčenín na medziprodukty a konečné látky.
Látka
Vstup do cely
Umiestnenie a konverzia
Vlastnosti
V rastlinách - z prostredia; u živočíchov sa tvorí priamo v bunke počas
sacharidov a pochádza z prostredia
V cytoplazme, vakuoly, matrix organel, jadrová šťava, bunková stena, medzibunkové priestory. Vstupuje do reakcií syntézy, hydrolýzy a oxidácie
Solventný. zdroj kyslíka, osmotický regulátor, prostredie pre fyziologické a biochemické procesy,
chemická zložka, termoregulátor
Stojí za zmienku, že rôzne organické látky pri oxidácii tvoria rôzne množstvá vody. Čím je molekula organickej hmoty bohatšia na vodík, tým viac vody vzniká pri jej oxidácii. Keď sa zoxiduje 100 g tuku, vznikne 107 ml vody, 100 g sacharidov - 55 ml vody, 100 g bielkovín - 41 ml vody.
Denná potreba vody v ľudskom tele je asi 40 g vody na 1 kg telesnej hmotnosti. U dojčiat je potreba vody na 1 kg hmotnosti trikrát až štyrikrát vyššia ako u dospelých.
Voda v organizmoch živých bytostí plní nielen transportnú funkciu, ale využíva sa aj pri metabolických procesoch. K inkorporácii vody do organických látok dochádza vo veľkom meradle v zelených rastlinách, v ktorých sa z vody, oxidu uhličitého a minerálnych dusíkatých látok pomocou slnečnej energie syntetizujú sacharidy, bielkoviny, lipidy a iné organické látky.
Prúdenie vody do tela je regulované pocitom smädu. Už pri prvých príznakoch zhrubnutia krvi v dôsledku reflexnej excitácie určitých častí mozgovej kôry vzniká smäd - túžba piť. Pri konzumácii aj väčšieho množstva vody naraz sa krv neobohatí vodou hneď, neskvapalní. Vysvetľuje to skutočnosť, že voda z krvi rýchlo vstupuje do medzibunkových priestorov a zvyšuje množstvo medzibunkovej vody. Voda vstrebaná do krvi a čiastočne do lymfy z čriev sa vo veľkej miere dostáva do kože a nejaký čas tam zotrváva. Pečeň tiež zadržiava určité množstvo vody, ktorá sa dostala do tela.
Voda sa z tela vylučuje hlavne obličkami močom, v malom množstve sa vylučuje stenami čriev, potom potnými žľazami (cez kožu) a pľúcami s vydychovaným vzduchom. Množstvo vody vylučovanej z tela nie je konštantné. Pri silnom potení sa môže z tela vylučovať s potom 5 a viac litrov vody denne. V tomto prípade sa množstvo vody vylučovanej obličkami znižuje, moč sa zahusťuje. Znižuje vylučovanie moču pri obmedzenom pití. Do určitej hranice je však možné zahustenie moču a pri ďalšom obmedzení pitia sa oneskoruje vylučovanie konečných produktov metabolizmu dusíka a minerálov z tela, čo negatívne ovplyvňuje životnú činnosť organizmu. Pri bohatom príjme vody v tele sa zvyšuje výdaj moču.
Voda v prírode. Voda je na Zemi veľmi rozšírená látka. Takmer 3 4 povrchy zemegule sú pokryté vodou a tvoria oceány, moria, rieky a jazerá. Veľa vody je v atmosfére v plynnom stave ako para; v podobe obrovských más snehu a ľadu leží celoročne na vrcholkoch vysokých hôr a v polárnych krajinách. V útrobách zeme je aj voda, ktorá nasiakne pôdu a skaly.
Voda má veľký význam v živote rastlín, zvierat a ľudí. Podľa moderných predstáv je samotný vznik života spojený s morom. V každom organizme je voda médiom, v ktorom prebiehajú chemické procesy, ktoré zabezpečujú životne dôležitú činnosť organizmu; okrem toho sa sama zúčastňuje na množstve biochemických reakcií.
Čistá voda je bezfarebná priehľadná kvapalina. Hustota vody na prechode jej z pevného do kvapalného stavu neklesá, ako takmer u všetkých ostatných látok, ale stúpa. Keď sa voda zohreje z 0 predtým 4 S jeho hustotou sa tiež zvyšuje. Pri 4 C má voda maximálnu hustotu a až ďalším zahrievaním sa jej hustota znižuje.
Veľký význam v živote prírody má fakt, že voda. má abnormálne vysokú tepelnú kapacitu, preto v noci, ako aj pri prechode z leta na zimu sa voda pomaly ochladzuje a cez deň alebo pri prechode zo zimy do leta sa pomaly aj ohrieva, čím je teplota regulátora na svete.
Molekula vody má hranatú štruktúru; jadrá zahrnuté v jeho zložení tvoria rovnoramenný trojuholník, na ktorého základni sú dva protóny, a na vrchu - jadro atómu kyslíka, medzijadrové vzdialenosti O- sú blízke 0,1 nm, vzdialenosť medzi jadrami atómov vodíka je približne 0,15 nm. A osem elektrónov, ktoré tvoria vonkajšiu elektrónovú vrstvu atómu kyseliny loroda v molekule vody
Voda je vysoko reaktívna látka. Oxidy mnohých kovov a nekovov sa spájajú s vodou za vzniku zásad a kyselín; niektoré soli tvoria s vodou kryštalické hydráty; najaktívnejšie kovy interagujú s vodou za uvoľňovania vodíka.
Voda má tiež katalytickú schopnosť. Pri absencii stôp vlhkosti sa niektoré z bežných reakcií takmer nevyskytujú; napríklad chlór neinteraguje s kovmi, fluorovodík nekoroduje sklo a sodík neoxiduje na vzduchu.
Voda sa dokáže zlučovať s množstvom látok, ktoré sú za normálnych podmienok v plynnom skupenstve, čím vznikajú takzvané plynové hydráty. Príkladom sú zlúčeniny Xe 6H O, CI 8HO, CH 6H O, CH 17H O, ktoré sa zrážajú vo forme kryštálov pri teplotách od 0 do 24 °C (zvyčajne pri zvýšenom tlaku príslušného plynu). Takéto zlúčeniny vznikajú ako výsledok naplnenia medzimolekulárnych dutín prítomných v štruktúre vody („hostiteľ“) molekulami plynu („hosť“); nazývajú sa inklúzne zlúčeniny alebo klatráty.
Purínové nukleozidy:
Pyrimidínové nukleozidy:
ENZÝMY, organické látky bielkovinovej povahy, ktoré sa syntetizujú v bunkách a mnohokrát urýchľujú reakcie v nich prebiehajúce bez toho, aby prešli chemickými premenami. Látky, ktoré majú podobný účinok, existujú v neživej prírode a nazývajú sa katalyzátory. Enzýmy (z lat. fermentum – kvasenie, kvas) sa niekedy nazývajú enzýmy (z gréčtiny en – vnútro, zyme – kvas). Všetky živé bunky obsahujú veľmi veľký súbor enzýmov, od katalytickej aktivity ktorých závisí fungovanie buniek. Takmer každá z mnohých rôznych reakcií, ktoré sa vyskytujú v bunke, vyžaduje účasť špecifického enzýmu. Štúdium chemických vlastností enzýmov a reakcií, ktoré katalyzujú, je špeciálna, veľmi dôležitá oblasť biochémie - enzymológia.
Mnohé enzýmy sú v bunke vo voľnom stave, sú jednoducho rozpustené v cytoplazme; iné sú spojené so zložitými vysoko organizovanými štruktúrami. Existujú aj enzýmy, ktoré sú normálne mimo bunky; teda enzýmy, ktoré katalyzujú rozklad škrobu a bielkovín, sú vylučované pankreasom do čriev. Vylučujú enzýmy a mnohé mikroorganizmy.
Prvé údaje o enzýmoch boli získané štúdiom procesov fermentácie a trávenia. L. Pasteur významne prispel k štúdiu fermentácie, ale veril, že iba živé bunky môžu vykonávať zodpovedajúce reakcie. Na začiatku 20. stor E. Buchner ukázal, že fermentáciu sacharózy za tvorby oxidu uhličitého a etylalkoholu môže katalyzovať bezbunkový kvasnicový extrakt. Tento dôležitý objav podnietil izoláciu a štúdium bunkových enzýmov. V roku 1926 J. Sumner z Cornell University (USA) izoloval ureázu; bol to prvý enzým získaný v prakticky čistej forme. Odvtedy bolo objavených a izolovaných viac ako 700 enzýmov, no oveľa viac ich existuje v živých organizmoch. Identifikácia, izolácia a štúdium vlastností jednotlivých enzýmov zaujíma ústredné miesto v modernej enzymológii.
Enzýmy zapojené do základných procesov premeny energie, ako je štiepenie cukrov, tvorba a hydrolýza vysokoenergetickej zlúčeniny adenozíntrifosfátu (ATP), sú prítomné vo všetkých typoch buniek – živočíšnych, rastlinných, bakteriálnych. Existujú však enzýmy, ktoré sa produkujú iba v tkanivách určitých organizmov. Enzýmy zapojené do syntézy celulózy sa teda nachádzajú v rastlinných bunkách, ale nie v živočíšnych. Preto je dôležité rozlišovať medzi „univerzálnymi“ enzýmami a enzýmami špecifickými pre určité typy buniek. Všeobecne povedané, čím je bunka špecializovanejšia, tým je pravdepodobnejšie, že syntetizuje súbor enzýmov potrebných na vykonávanie konkrétnej bunkovej funkcie.
Enzýmy sú ako bielkoviny. Všetky enzýmy sú proteíny, jednoduché alebo komplexné (t. j. obsahujúce spolu s proteínovou zložkou aj neproteínovú časť). Pozri tiež PROTEÍNY.
Enzýmy sú veľké molekuly, ich molekulová hmotnosť sa pohybuje od 10 000 do viac ako 1 000 000 daltonov (Da). Pre porovnanie si povedzme. hmotnosti známych látok: glukóza - 180, oxid uhličitý - 44, aminokyseliny - od 75 do 204 Da. Enzýmy, ktoré katalyzujú rovnaké chemické reakcie, ale izolované z buniek rôznych typov, sa líšia vlastnosťami a zložením, ale zvyčajne majú určitú štrukturálnu podobnosť.
Štrukturálne vlastnosti enzýmov potrebné na ich fungovanie sa ľahko stratia. Takže pri zahrievaní sa proteínový reťazec preusporiada, čo je sprevádzané stratou katalytickej aktivity. Dôležité sú aj alkalické alebo kyslé vlastnosti roztoku. Väčšina enzýmov funguje najlepšie v roztokoch s pH blízkym 7, keď je koncentrácia iónov H+ a OH- približne rovnaká. Je to spôsobené tým, že štruktúra molekúl proteínov a následne aj aktivita enzýmov silne závisia od koncentrácie vodíkových iónov v médiu.
Nie všetky proteíny prítomné v živých organizmoch sú enzýmy. Inú funkciu teda plnia štrukturálne proteíny, mnohé špecifické krvné proteíny, proteínové hormóny atď.
koenzýmy a substráty. Mnohé enzýmy s veľkou molekulovou hmotnosťou vykazujú katalytickú aktivitu iba v prítomnosti špecifických látok s nízkou molekulovou hmotnosťou nazývaných koenzýmy (alebo kofaktory). Úlohu koenzýmov zohráva väčšina vitamínov a mnohé minerály; preto sa musia prijímať s jedlom. Vitamíny PP (kyselina nikotínová alebo niacín) a napríklad riboflavín sú súčasťou koenzýmov nevyhnutných pre fungovanie dehydrogenáz. Zinok je koenzým karboanhydrázy, enzýmu, ktorý katalyzuje uvoľňovanie oxidu uhličitého z krvi, ktorý sa odstraňuje z tela spolu s vydychovaným vzduchom. Železo a meď sú súčasťou respiračného enzýmu cytochrómoxidázy.
Látka, ktorá prechádza transformáciou v prítomnosti enzýmu, sa nazýva substrát. Substrát sa pripojí k enzýmu, ktorý urýchľuje rozpad niektorých chemických väzieb v jeho molekule a tvorbu iných; výsledný produkt sa oddelí od enzýmu. Tento proces je prezentovaný takto:
Mechanizmus účinku enzýmov. Rýchlosť enzymatickej reakcie závisí od koncentrácie substrátu [S] a množstva prítomného enzýmu. Tieto hodnoty určujú, koľko molekúl enzýmu bude pripojených k substrátu a rýchlosť reakcie katalyzovanej týmto enzýmom závisí od obsahu komplexu enzým-substrát. Vo väčšine situácií, ktoré zaujímajú biochemikov, je koncentrácia enzýmu veľmi nízka a substrát je prítomný v nadbytku. Okrem toho biochemici študujú procesy, ktoré dosiahli ustálený stav, pri ktorom sa tvorba komplexu enzým-substrát vyrovnáva jeho premenou na produkt.
Objasnenie mechanizmov pôsobenia enzýmov vo všetkých detailoch je otázkou budúcnosti, avšak niektoré ich dôležité vlastnosti sú už stanovené. Každý enzým má jedno alebo viac aktívnych miest, na ktoré sa substrát viaže. Tieto centrá sú vysoko špecifické; „rozpoznať“ len „svoj“ substrát alebo blízko príbuzné zlúčeniny. Aktívne centrum je tvorené špeciálnymi chemickými skupinami v molekule enzýmu, ktoré sú voči sebe určitým spôsobom orientované. Strata enzymatickej aktivity, ku ktorej dochádza tak ľahko, je spojená práve so zmenou vzájomnej orientácie týchto skupín. Molekula substrátu spojená s enzýmom prechádza zmenami, v dôsledku ktorých sa niektoré chemické väzby prerušia a vytvoria sa iné chemické väzby. Aby sa tento proces uskutočnil, je potrebná energia; úlohou enzýmu je znížiť energetickú bariéru, ktorú musí substrát prekonať, aby sa premenil na produkt. Ako presne sa toto zníženie dosiahne, nebolo úplne stanovené.
Enzymatické reakcie a energia. Uvoľňovanie energie počas metabolizmu živín, ako je oxidácia šesťuhlíkového cukru glukózy na oxid uhličitý a vodu, nastáva v dôsledku postupných koordinovaných enzymatických reakcií. V živočíšnych bunkách sa na premene glukózy na kyselinu pyrohroznovú (pyruvát) alebo kyselinu mliečnu (laktát) podieľa 10 rôznych enzýmov. Tento proces sa nazýva glykolýza. Prvá reakcia, fosforylácia glukózy, vyžaduje účasť ATP. Premena každej molekuly glukózy na dve molekuly kyseliny pyrohroznovej spotrebuje dve molekuly ATP, ale súčasne sa z adenozíndifosfátu (ADP) v medzistupňoch vytvoria 4 molekuly ATP, takže celý proces dáva 2 molekuly ATP.
Ďalej sa kyselina pyrohroznová oxiduje na oxid uhličitý a vodu za účasti enzýmov spojených s mitochondriami. Tieto premeny tvoria cyklus nazývaný cyklus trikarboxylových kyselín alebo cyklus kyseliny citrónovej. Pozri tiež METABOLIZMUS.
Oxidácia jednej látky je vždy spojená s redukciou inej: prvá sa vzdáva atómu vodíka a druhá ho pridáva. Tieto procesy sú katalyzované dehydrogenázami, ktoré zabezpečujú prenos atómov vodíka zo substrátov na koenzýmy. V cykle trikarboxylových kyselín niektoré špecifické dehydrogenázy oxidujú substráty za vzniku redukovanej formy koenzýmu (nikotínamid dinukleotid, označený NAD), zatiaľ čo iné oxidujú redukovaný koenzým (NADH), čím obnovujú iné respiračné enzýmy vrátane cytochrómov (hemoproteíny obsahujúce železo). , v ktorom sa atóm železa striedavo oxiduje, potom redukuje. V konečnom dôsledku je redukovaná forma cytochrómoxidázy, jedného z kľúčových enzýmov obsahujúcich železo, oxidovaná kyslíkom vstupujúcim do nášho tela vdychovaným vzduchom. Keď sa cukor spaľuje (oxiduje vzdušným kyslíkom), jeho atómy uhlíka priamo interagujú s kyslíkom a vytvárajú oxid uhličitý. Na rozdiel od spaľovania, keď sa cukor v tele oxiduje, kyslík oxiduje vlastné železo cytochrómoxidázy, ale jeho oxidačný potenciál sa nakoniec využije na úplnú oxidáciu cukrov vo viacstupňovom procese sprostredkovanom enzýmami.
V jednotlivých štádiách oxidácie sa energia obsiahnutá v živinách uvoľňuje prevažne v malých dávkach a môže sa ukladať do fosfátových väzieb ATP. To zahŕňa úžasné enzýmy, ktoré spájajú oxidačné reakcie (produkujúce energiu) s reakciami tvorby ATP (ukladanie energie). Tento kopulačný proces je známy ako oxidačná fosforylácia. Ak by neexistovali spojené enzymatické reakcie, život v nám známych formách by bol nemožný.
Enzýmy vykonávajú aj mnoho ďalších funkcií. Katalyzujú rôzne syntézne reakcie, vrátane tvorby tkanivových proteínov, tukov a uhľohydrátov. Na syntézu obrovského množstva chemických zlúčenín nachádzajúcich sa v zložitých organizmoch sa používajú celé enzýmové systémy. To si vyžaduje energiu a vo všetkých prípadoch pochádza z fosforylovaných zlúčenín, ako je ATP.
Enzýmy a trávenie. Enzýmy sú nevyhnutnými účastníkmi procesu trávenia. Len zlúčeniny s nízkou molekulovou hmotnosťou môžu prejsť cez črevnú stenu a dostať sa do krvného obehu, takže zložky potravy sa musia najskôr rozložiť na malé molekuly. K tomu dochádza pri enzymatickej hydrolýze (rozklade) bielkovín na aminokyseliny, škrobu na cukry, tukov na mastné kyseliny a glycerol. Hydrolýzu bielkovín katalyzuje enzým pepsín obsiahnutý v žalúdku. Pankreasom sa do čriev vylučuje množstvo vysoko účinných tráviacich enzýmov. Ide o trypsín a chymotrypsín, ktoré hydrolyzujú proteíny; lipáza, ktorá rozkladá tuky; amyláza katalyzuje rozklad škrobu. Pepsín, trypsín a chymotrypsín sa vylučujú v neaktívnej forme, vo forme tzv. zymogény (proenzýmy) a aktivujú sa až v žalúdku a črevách. To vysvetľuje, prečo tieto enzýmy neničia bunky pankreasu a žalúdka. Steny žalúdka a čriev sú chránené pred tráviacimi enzýmami a vrstvou hlienu. Niekoľko dôležitých tráviacich enzýmov je vylučovaných bunkami v tenkom čreve.
Väčšina energie uloženej v rastlinnej potrave, ako je tráva alebo seno, je uložená v celulóze, ktorú rozkladá enzým celuláza. V tele bylinožravcov sa tento enzým nesyntetizuje a prežúvavce, ako je dobytok a ovce, môžu jesť potravu obsahujúcu celulózu len preto, že celulázu produkujú mikroorganizmy, ktoré obývajú prvú časť žalúdka – bachor. Termity trávia potravu aj pomocou mikroorganizmov.
Enzýmy sa využívajú v potravinárskom, farmaceutickom, chemickom a textilnom priemysle. Príkladom je rastlinný enzým získaný z papáje a používaný na zmäkčenie mäsa. Enzýmy sa pridávajú aj do pracích práškov.
Enzýmy v medicíne a poľnohospodárstve. Uvedomenie si kľúčovej úlohy enzýmov vo všetkých bunkových procesoch viedlo k ich širokému použitiu v medicíne a poľnohospodárstve. Normálne fungovanie akéhokoľvek rastlinného a živočíšneho organizmu závisí od efektívnej činnosti enzýmov. Pôsobenie mnohých toxických látok (jedov) je založené na ich schopnosti inhibovať enzýmy; viaceré lieky majú rovnaký účinok. Účinok lieku alebo toxickej látky možno často vysledovať podľa jeho selektívneho účinku na prácu konkrétneho enzýmu v tele ako celku alebo v konkrétnom tkanive. Napríklad silné organofosforové insekticídy a nervové látky vyvinuté na vojenské účely majú svoj škodlivý účinok tým, že blokujú prácu enzýmov - predovšetkým cholínesterázy, ktorá hrá dôležitú úlohu pri prenose nervových vzruchov.
Pre lepšie pochopenie mechanizmu účinku liekov na enzýmové systémy je užitočné zvážiť, ako fungujú niektoré inhibítory enzýmov. Mnoho inhibítorov sa viaže na aktívne miesto enzýmu, s ktorým substrát interaguje. V takýchto inhibítoroch sú najdôležitejšie štruktúrne znaky blízke štruktúrnym znakom substrátu a ak sú substrát aj inhibítor prítomné v reakčnom médiu, súťažia o väzbu na enzým; čím vyššia je koncentrácia substrátu, tým úspešnejšie konkuruje inhibítoru. Inhibítory iného typu vyvolávajú konformačné zmeny v molekule enzýmu, ktoré zahŕňajú funkčne dôležité chemické skupiny. Štúdium mechanizmu účinku inhibítorov pomáha chemikom vytvárať nové lieky.
Glykolýza.
Glykolýza je prvou a v anaeróbnych podmienkach hlavnou etapou na ceste „využitia glukózy a iných sacharidov na uspokojenie bioenergetických potrieb živých organizmov. Okrem toho v medzistupňoch glykolýzy vznikajú trojuhlíkové fragmenty, ktoré sa využívajú na biosyntézu množstva látok.
Základným krokom glykolýzy je oxidačná degradácia glukózy na dve molekuly pyruvátu, soli kyseliny pyrohroznovej, s použitím dvoch molekúl NAD ako oxidačného činidla. Stereometrická rovnica procesu je napísaná takto:
1. Konverzia glukózy na glukóza-6-fosfát katalyzovaná hexokinázou:
2. Izomerizácia glukóza-6-fosfátu na fruktóza-6-fosfát katalyzovaná glukózo-6-fosfát izomerázou:
3. Fosforylácia fruktóza-b-fosfátu na fruktóza-1,6-difosfát, katalyzovaná 6-fosfofruktognázou:
4. Rozklad fruktóza-1,6-dpfosfátu na glcsraldegpd-3-fosfát a dihydroxyacetónfosfát katalyzovaný fruktózou a fosfát aldolázou:
5. Izomerizácia dihydroxyacetónfosfátu na glyceraldehyd-3-fosfát katalyzovaná triózofosfátizomerázou:
Ak sú následné kroky prevládajúcou cestou konverzie glukózy, potom táto reakcia poskytuje postupné zastavenie dihydroxacetónfosfátu na glyceraldehyd-3-fosfát.
6. Oxidácia glyceraldehyd-3-fosfátu na 1,3-difosfaglycerát katalyzovaná glyceraldehyd-3-fosfátdehydrogenázou:
Proces prebieha prostredníctvom prechodnej tvorby triesteru medzi oxidovateľnou aldehydovou skupinou a SII-skupinou zvyšku Znsteppa, ktorý prechádza do aktívneho centra enzýmu. Táto väzba sa potom podrobí fosforolýze s anorganickým fosfátom s regeneráciou aktívneho miesta a vytvorením zmiešaného anhydridu kyseliny 3-fosfoglycerovej a kyseliny fosforečnej:
7. Prenos fosfátu z 1,3-dpfosfoglycerátu na ADP za vzniku molekuly ATP, katalyzovaný fosfoglycerátkinázou (názov je uvedený v súlade s reverznou reakciou):
8. Izomerizácia 3-fosfoglycerátu na 2-fosfoglycerát katalyzovaná fosfoglycerátmutázou:
9. Dehydratácia 2-fosfoglycerátu, katalyzovaná euolázou p, vedúca k vytvoreniu silného makroergu - fosfoeiolprovátu:
10. Prenos fosfátu z fosfoenolpyruvátu na ADP s tvorbou ďalšej molekuly ATP, katalyzovaný pyruoátkinázou (názov je uvedený v súlade s reverznou reakciou):
Pred zhrnutím týchto rovníc je potrebné venovať pozornosť skutočnosti, že v prvých štádiách glykolýzy sa dve makroergické väzby v molekulách A-GP spotrebujú na premenu glukózy na glukóza-6-fosfát a fruktóza-6-fosfát na fruktózu- 1,6-difosfát V nasledujúcich štádiách sa na jednu počiatočnú molekulu glukózy fosforylujú dve molekuly ADP v reakcii a dve v reakcii. Výsledkom je teda premena dvoch molekúl ADP a dvoch molekúl ortofosfátu na dve molekuly ATP. Vzhľadom na to by mala byť celková rovnica napísaná takto:
Ak počítame z glukózo-6-fosfátu, rovnica bude mať tvar:
Schéma glykolýzy (premena glukózy na dve molekuly pyruvátu)
natívne a denaturované proteíny.
Proteíny a nukleové kyseliny v živých organizmoch vznikajú postupným predlžovaním polymérneho reťazca monomérnymi jednotkami, ktorých poradie pripojenia je určené nukleovými kyselinami, ktoré programujú biosyntézu. Tieto samotné však určujú iba primárnu štruktúru vytvoreného biopolyméru. Aby biopolymér prijal prirodzenú štruktúru potrebnú pre jeho fungovanie, je potrebné, aby bola táto naprogramovaná samotnou primárnou štruktúrou proteínu.
Pôvodnosť proteínu je určená triciárnou štruktúrou. Natívny proteín je proteín schopný vykonávať všetky biologické funkcie. Tritická štruktúra je ľahko zničená v dôsledku zmien pH média, zmien teploty, solí ťažkých kovov atď. Proteín so stúpajúcou teplotou stráca svoje vlastnosti a nevyhnutne prichádza čas, keď sa natívna štruktúra stane termodynamicky nestabilnou. Jeho deštrukcia vedie k tomu, že polypeptidový reťazec stráca usporiadané potvrdenie a mení sa na polymér s neustále sa meniacou priestorovou štruktúrou. V chémii makromolekulových zlúčenín sa takéto útvary nazývajú štatistická cievka. V biochémii sa transformácia natívneho proteínu na náhodnú cievku nazýva denaturácia proteínu.
Denaturovaný proteín je zbavený akejkoľvek biologickej aktivity a v biologických systémoch ho možno využiť hlavne len ako zdroj aminokyselín, t.j. ako potravina.
Reverzná transformácia denaturovaného proteínu na natívny proteín je možná len vtedy, keď je natívna štruktúra naprogramovaná v primárnej štruktúre.
vitamínyskupinyD.
Je známych asi desať vitamínov D, ktoré sa mierne líšia štruktúrou. Všetky patria do skupiny steroidov - komplexných organických zlúčenín s kondenzovanými kruhmi. Všetky vitamíny D sa podieľajú na riadení ukladania vápnika a fosforu v rastúcich ľudských kostiach. Pri nedostatku vitamínu D je tento proces narušený, čo spôsobuje zmäkčenie a deformáciu kostí. Tento jav sa nazýva rachitída a je charakteristický iba pre detstvo.
Vitamín D sa nachádza v niektorých potravinách, ale v množstve, ktoré je nedostatočné pre ľudský rast. Chýbajúce množstvo vitamínu D telo kompenzuje prítomnosťou 7-dehydrocholesterolu v tele - zlúčeniny zo skupiny steroidov, podobnej štruktúre ako vitamíny D. 7-dehydrocholesterol obsiahnutý priamo pod kožou človek sa pôsobením slnečného žiarenia mení na vitamín D3:
Vitamín D (kalciferol] je štruktúrou veľmi podobný vitamínu D3 a vzniká zo steroidného alkoholu – ergosterolu, obsiahnutého v kvasinkách, plesniach a pod., aj vplyvom ožiarenia.
Štruktúrny vzorec peptidu je valyl-izoleucyl-metionyl-agenín.
Bibliografia
1. D.E., Technika a výroba. M., 1972
2. Khomchenko G.P. , Chémia pre uchádzačov o VŠ. M., 1995
3. Prokofiev M.A., Encyklopedický slovník mladého chemika. M., 1982
4. Glinka N.L., Všeobecná chémia. Leningrad, 1984
5. N. S. Achmetov, Anorganická chémia. Moskva, 1992





