Elemente ale grupului IVA. Elemente din grupa IVA Caracteristici generale ale elementelor din grupele IIIA, IVA și VA
| Element | C | Si | GE | Sn | Pb |
|---|---|---|---|---|---|
| Număr de serie | 6 | 14 | 32 | 50 | 82 |
| Masa atomică (relativă) | 12,011 | 28,0855 | 72,59 | 118,69 | 207,2 |
| Densitate (n.s.), g/cm3 | 2,25 | 2,33 | 5,323 | 7,31 | 11,34 |
| t pl, °C | 3550 | 1412 | 273 | 231 | 327,5 |
| t kip, °C | 4827 | 2355 | 2830 | 2600 | 1749 |
| Energia de ionizare, kJ/mol | 1085,7 | 786,5 | 762,1 | 708,6 | 715,2 |
| Formula electronica | 2s 2 2p 2 | 3s 2 3p 2 | 3d 10 4s 2 4p 2 | 4d 10 5s 2 5p 2 | 4f 14 5d 10 6s 2 6p 2 |
| Electronegativitatea (după Pauling) | 2,55 | 1,9 | 2,01 | 1,96 | 2,33 |
Formule electronice ale gazelor nobile:
- El - 1s 2 ;
- Ne - 1s 2 2s 2 2p 6 ;
- Ar - 1s 2 2s 2 2p 6 3s 2 3p 6 ;
- Kr - 3d 10 4s 2 4p 6 ;
- Xe - 4d 10 5s 2 5p 6 ;
Orez. Structura atomului de carbon.
Grupa 14 (grupa IVa conform clasificării vechi) din tabelul periodic al elementelor chimice al lui D. I. Mendeleev include 5 elemente: carbon, siliciu, germaniu, staniu, plumb (vezi tabelul de mai sus). Carbonul și siliciul sunt nemetale, germaniul este o substanță care prezintă proprietăți metalice, staniul și plumbul sunt metale tipice.
Cel mai comun element din grupa 14(IVa) din scoarța terestră este siliciul (al doilea element cel mai abundent de pe Pământ după oxigen) (27,6% din masă), urmat de: carbon (0,1%), plumb (0,0014%), staniu ( 0,00022%), germaniu (0,00018%).
Siliciul, spre deosebire de carbon, nu se găsește în formă liberă în natură; el poate fi găsit doar sub formă legată:
- SiO 2 - silice, găsit sub formă de cuarț (parte a multor roci, nisip, argilă) și varietățile sale (agat, ametist, cristal de rocă, jasp etc.);
- silicati bogati in siliciu: talc, azbest;
- aluminosilicati: feldspat, mica, caolin.
De asemenea, germaniul, staniul și plumbul nu se găsesc în formă liberă în natură, dar fac parte din unele minerale:
- germaniu: (Cu 3 (Fe, Ge)S 4) - mineralit de germanit;
- staniu: SnO 2 - casiterit;
- plumb: PbS - galena; PbSO 4 - anglesite; PbCO 3 - cerusită.
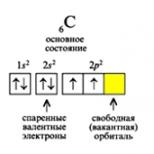
Toate elementele grupului 14(IVa) într-o stare neexcitată la nivelul energiei exterioare au doi electroni p nepereche (valența 2, de exemplu, CO). Când treceți la o stare excitată (procesul necesită energie), un electron s pereche al nivelului exterior „sare” la un orbital p liber, formând astfel 4 electroni „singuratici” (unul la subnivelul s și trei la nivelul p-sublevel) , care extinde capacitățile de valență ale elementelor (valența este 4: de exemplu, CO 2 ).

Orez. Tranziția unui atom de carbon într-o stare excitată.
Din motivul de mai sus, elementele grupului 14(IVa) pot prezenta stări de oxidare: +4; +2; 0; -4.
Deoarece „saritul” unui electron de la subnivelul s la subnivelul p din seria de la carbon la plumb necesită din ce în ce mai multă energie (este necesară mult mai puțină energie pentru a excita un atom de carbon decât pentru a excita un atom de plumb), carbonul „mai binevoitor” intră în compuși în care valența este patru; și plumb - doi.
Același lucru se poate spune despre stările de oxidare: în seria de la carbon la plumb, manifestarea stărilor de oxidare +4 și -4 scade, iar starea de oxidare +2 crește.
Deoarece carbonul și siliciul sunt nemetale, ele pot prezenta fie o stare de oxidare pozitivă, fie negativă, în funcție de compus (în compușii cu mai multe elemente electronegative, C și Si renunță la electroni și câștigă în compușii cu elemente mai puțin electronegative):
C +2O, C +4O2, Si +4Cl4C-4H4, Mg2Si-4
Ge, Sn, Pb, ca metale din compuși, renunță întotdeauna la electroni:
Ge +4 Cl 4, Sn +4 Br 4, Pb +2 Cl 2
Elementele grupului de carbon formează următorii compuși:
- instabil compuși volatili ai hidrogenului(formula generală EH 4), din care doar metanul CH 4 este un compus stabil.
- oxizi care nu formează sare- oxizi inferiori CO si SiO;
- oxizi acizi- oxizi superiori CO 2 şi SiO 2 - corespund hidroxizilor, care sunt acizi slabi: H 2 CO 3 (acid carbonic), H 2 SiO 3 (acid silicic);
- oxizi amfoteri- GeO, SnO, PbO și GeO 2, SnO 2, PbO 2 - acestea din urmă corespund hidroxizilor (IV) de germaniu Ge(OH) 4, stronțiu Sn(OH) 4, plumb Pb(OH) 4;
Grupa IVA de elemente chimice ale tabelului periodic D.I. Mendeleev include nemetale (carbon și siliciu), precum și metale (germaniu, staniu, plumb). Atomii acestor elemente conțin patru electroni (ns 2 np 2) la nivelul energetic exterior, dintre care doi sunt nepereche. Prin urmare, atomii acestor elemente din compuși pot prezenta valența II. Atomii elementelor grupului IVA pot intra într-o stare excitată și pot crește numărul de electroni nepereche la 4 și, în consecință, în compuși prezintă o valență mai mare, egală cu numărul grupului IV. Carbonul din compuși prezintă stări de oxidare de la –4 la +4, în rest stările de oxidare sunt stabilizate: –4, 0, +2, +4.
Într-un atom de carbon, spre deosebire de toate celelalte elemente, numărul de electroni de valență este egal cu numărul de orbitali de valență. Acesta este unul dintre principalele motive pentru stabilitatea legăturii C-C și tendința excepțională a carbonului de a forma homolanțuri, precum și existența unui număr mare de compuși ai carbonului.
Periodicitatea secundară se manifestă prin modificări ale proprietăților atomilor și compușilor din seria C–Si–Ge–Sn–Pb (Tabelul 5).
Tabelul 5 - Caracteristicile atomilor elementelor grupei IV
| 6 C | 1 4 Si | 3 2 Ge | 50 Sn | 82 Pb | |
| Masă atomică | 12,01115 | 28,086 | 72,59 | 118,69 | 207,19 |
| electroni de valență | 2s 2 2p 2 | 3s 2 3p 2 | 4s 2 4p 2 | 5s 2 5p 2 | 6s 2 6p 2 |
| Raza covalentă a unui atom, Ǻ | 0,077 | 0,117 | 0,122 | 0,140 | – |
| Raza metalică a unui atom, Ǻ | – | 0,134 | 0,139 | 0,158 | 0,175 |
| Raza ionică condiționată, E 2+, nm | – | – | 0,065 | 0,102 | 0,126 |
| Raza condiționată a ionului E 4+, nm | – | 0,034 | 0,044 | 0,067 | 0,076 |
| Energia de ionizare E 0 – E + , ev | 11,26 | 8,15 | 7,90 | 7,34 | 7,42 |
| Conținut în scoarța terestră, la. % | 0,15 | 20,0 | 2∙10 –4 | 7∙10 – 4 | 1,6∙10 – 4 |
Periodicitatea secundară (modificarea nemonotonă a proprietăților elementelor în grupuri) se datorează naturii pătrunderii electronilor externi în nucleu. Astfel, modificarea nemonotonă a razelor atomice în timpul tranziției de la siliciu la germaniu și de la staniu la plumb se datorează pătrunderii electronilor s, respectiv, sub ecranul electronilor 3d 10 în germaniu și ecranul dublu al 4f 14. și 5d 10 electroni în plumb. Deoarece puterea de pătrundere scade în seria s>p>d, periodicitatea internă a modificării proprietăților se manifestă cel mai clar în proprietățile elementelor determinate de electroni s. Prin urmare, este cel mai tipic pentru compușii elementelor grupelor A ale sistemului periodic, corespunzătoare celei mai înalte stări de oxidare a elementelor.
Carbonul diferă semnificativ de alte elemente p ale grupului prin energia sa ridicată de ionizare.
Carbonul și siliciul au modificări polimorfe cu structuri diferite ale rețelelor cristaline. Germaniul este un metal de culoare alb-argintiu cu o nuanță gălbuie, dar are o rețea cristalină atomică asemănătoare unui diamant, cu legături covalente puternice. Staniul are două polimorfe: o modificare metalică cu o rețea cristalină metalică și o legătură metalică; o modificare nemetalica cu o retea cristalina atomica, care este stabila la temperaturi sub 13,8 C. Plumbul este un metal gri inchis cu o retea cristalina cubica centrata pe fata metalica. O modificare a structurii substanțelor simple din seria germaniu-staniu-plumb corespunde unei modificări a proprietăților lor fizice. Deci germaniul și staniul nemetalic sunt semiconductori, staniul metalic și plumbul sunt conductori. O schimbare a tipului de legătură chimică de la predominant covalent la metal este însoțită de o scădere a durității substanțelor simple. Astfel, germaniul este destul de dur, în timp ce plumbul este ușor rulat în foi subțiri.
Compușii elementelor cu hidrogen au formula EN 4: CH 4 - metan, SiH 4 - silan, GeH 4 - germaniu, SnH 4 - stanan, PbH 4 - plumban. Insolubil în apă. De sus în jos în seria compușilor cu hidrogen, stabilitatea acestora scade (plumbane este atât de instabil încât existența sa poate fi judecată doar prin semne indirecte).
Compușii elementelor cu oxigen au formule generale: EO și EO 2. Oxizii CO și SiO nu formează sare; GeO, SnO, PbO – oxizi amfoteri; CO 2 , SiO 2 GeO 2 – acid, SnO 2 , PbO 2 – amfoter. Pe măsură ce gradul de oxidare crește, proprietățile acide ale oxizilor cresc, în timp ce proprietățile de bază slăbesc. Proprietățile hidroxizilor corespunzători se modifică în mod similar.
| | | | | | | |
Elemente carbon C, siliciu Si, germaniu Ge, staniu Sn și plumb Pb alcătuiesc grupa IVA din Tabelul Periodic al D.I. Mendeleev. Formula electronică generală pentru nivelul de valență al atomilor acestor elemente este n s 2n p 2, stările de oxidare predominante ale elementelor din compuși sunt +2 și +4. În funcție de electronegativitatea lor, elementele C și Si sunt clasificate ca nemetale, iar Ge, Sn și Pb sunt clasificate ca elemente amfotere, ale căror proprietăți metalice cresc pe măsură ce numărul atomic crește. Prin urmare, în compușii staniului (IV) și plumbului (IV) legăturile chimice sunt covalente; cristalele ionice sunt cunoscute pentru plumb (II) și într-o măsură mai mică pentru staniu (II). În seria elementelor de la C la Pb, stabilitatea stării de oxidare +4 scade, iar starea de oxidare +2 crește. Compușii plumbului (IV) sunt agenți oxidanți puternici, în timp ce compușii altor elemente în starea de oxidare +2 sunt agenți reducători puternici.
Substanțe simple Carbonul, siliciul și germaniul sunt destul de inerți din punct de vedere chimic și nu reacționează cu apa și acizii neoxidanți. De asemenea, staniul și plumbul nu reacționează cu apa, dar sub influența acizilor neoxidanți intră în soluție sub formă de acvații de staniu(II) și plumb(II). Alcaliile nu transferă carbonul în soluție, siliciul este dificil de transferat, iar germaniul reacționează cu alcalii numai în prezența agenților de oxidare. Staniul și plumbul reacționează cu apa într-un mediu alcalin, transformându-se în hidroxocomplecși de staniu (II) și plumb (II). Reactivitatea substanțelor simple din grupa IVA crește odată cu creșterea temperaturii. Deci, atunci când sunt încălzite, toate reacţionează cu metale şi nemetale, precum şi cu acizi oxidanţi (HNO 3, H 2 SO 4 (conc.), etc.). În special, acidul azotic concentrat, atunci când este încălzit, oxidează carbonul la CO2; siliciul se dizolvă chimic într-un amestec de HNO3 și HF, transformându-se în hexafluorosilicat de hidrogen H2. Acidul azotic diluat transformă staniul în nitrat de staniu (II), iar acidul concentrat îl transformă în oxid de staniu (IV) hidratat SnO 2 n H 2 O, numit β -acid tinic. Plumbul sub influența acidului azotic fierbinte formează nitrat de plumb(II), în timp ce acidul azotic rece pasivează suprafața acestui metal (se formează o peliculă de oxid).
Carbonul sub formă de cocs este folosit în metalurgie ca agent reducător puternic care formează CO și CO 2 în aer. Acest lucru face posibilă obținerea de Sn și Pb liber din oxizii lor - SnO 2 și PbO natural, obținuți prin prăjirea minereurilor care conțin sulfură de plumb. Siliciul poate fi obţinut prin metoda magnezio-termică din SiO 2 (cu un exces de magneziu se formează şi siliciura Mg 2 Si).
Chimie carbon- Aceasta este în principal chimia compușilor organici. Carburele sunt tipice derivaților de carbon anorganic: asemănătoare sărurilor (cum ar fi CaC2 sau Al4C3), covalente (SiC) și asemănătoare metalelor (de exemplu, Fe3C și WC). Multe carburi asemănătoare sărurilor sunt complet hidrolizate cu eliberarea de hidrocarburi (metan, acetilenă etc.).
Carbonul formează doi oxizi: CO și CO 2 . Monoxidul de carbon este utilizat în pirometalurgie ca agent reducător puternic (transformă oxizii metalici în metale). CO este, de asemenea, caracterizat prin reacții de adiție cu formarea de complecși carbonilici, de exemplu. Monoxidul de carbon este un oxid care nu formează sare; este otrăvitor („monoxid de carbon”). Dioxidul de carbon este un oxid acid; în soluție apoasă există sub formă de monohidrat CO 2 · H 2 O și acid carbonic dibazic slab H 2 CO 3. Sărurile solubile ale acidului carbonic - carbonați și bicarbonați - datorate hidrolizei au un pH > 7.
Siliciu formează mai mulți compuși cu hidrogen (silani), care sunt foarte volatili și reactivi (se aprind spontan în aer). Pentru a obține silani, se utilizează interacțiunea siliciurilor (de exemplu, siliciura de magneziu Mg 2 Si) cu apa sau acizii.
Siliciul în starea de oxidare +4 face parte din SiO 2 și foarte numeroși și adesea foarte complexi ca structură și compoziție ioni de silicat (SiO 4 4–; Si 2 O 7 6–; Si 3 O 9 6–; Si 4 O 11 6) – ; Si 4 O 12 8– etc.), al cărui fragment elementar este grupul tetraedric. Dioxidul de siliciu este un oxid acid; reacţionează cu alcalii la fuziune (formând polimetasilicaţi) şi în soluţie (formând ioni de ortosilicat). Din soluții de silicați de metale alcaline sub acțiunea acizilor sau a dioxidului de carbon se eliberează un precipitat de dioxid de siliciu hidrat SiO 2 n H 2 O, în echilibru cu care acidul orto-silicic slab H 4 SiO 4 se găsește întotdeauna în soluție în concentrație mică. Soluțiile apoase de silicați de metale alcaline datorate hidrolizei au un pH > 7.
StaniuȘi conduceîn starea de oxidare +2 formează oxizii SnO şi PbO. Oxidul de staniu(II) este instabil termic și se descompune în SnO 2 și Sn. Oxidul de plumb(II), dimpotrivă, este foarte stabil. Se formează atunci când plumbul arde în aer și apare în mod natural. Hidroxizii de staniu (II) și plumb (II) sunt amfoteri.
Acvatarea cu staniu(II) prezintă proprietăți acide puternice și, prin urmare, este stabilă numai la pH< 1 в среде хлорной или азотной кислот, анионы которых не обладают заметной склонностью входить в состав комплексов олова(II) в качестве лигандов. При разбавлении таких растворов выпадают осадки основных солей различного состава. Галогениды олова(II) – ковалентные соединения, поэтому при растворении в воде, например, SnCl 2 протекает вначале гидратация с образованием , а затем гидролиз до выпадения осадка вещества условного состава SnCl(OH). При наличии избытка хлороводородной кислоты, SnCl 2 находится в растворе в виде комплекса – . Большинство солей свинца(II) (например, иодид, хлорид, сульфат, хромат, карбонат, сульфид) малорастворимы в воде.
Oxizii de staniu (IV) și plumb (IV) sunt amfoteri cu o predominanță a proprietăților acide. Ele corespund polihidraților EO 2 · n H 2 O, trecând în soluție sub formă de complecși hidroxo sub influența excesului de alcalii. Oxidul de staniu(IV) se formează prin arderea staniului în aer, iar oxidul de plumb(IV) poate fi obținut numai prin acțiunea agenților oxidanți puternici (de exemplu, hipoclorit de calciu) asupra compușilor plumbului(II).
Clorura covalentă de staniu(IV) este complet hidrolizată de apă, eliberând SnO2, iar clorura de plumb(IV) se descompune sub influența apei, eliberând clor și fiind redusă la clorura de plumb(II).
Compușii de staniu(II) prezintă proprietăți reducătoare, mai ales puternice într-un mediu alcalin, iar compușii de plumb (IV) prezintă proprietăți oxidante, mai ales puternice într-un mediu acid. Un compus comun de plumb este oxidul său dublu (Pb 2 II Pb IV) O 4. Acest compus se descompune sub acțiunea acidului azotic, iar plumbul (II) intră în soluție sub formă de cation, iar oxidul de plumb (IV) precipită. Plumbul(IV) prezent în oxidul dublu determină proprietățile puternic oxidante ale acestui compus.
Datorită naturii amfoterice a acestor elemente, sulfurile de germaniu (IV) și staniu (IV) formează tiosăruri solubile, de exemplu, Na2GeS3 sau Na2SnS3, atunci când se adaugă sulfură de sodiu în exces. Aceeași tiosare de staniu(IV) poate fi obținută din sulfura de staniu(II) SnS prin oxidarea acesteia cu polisulfură de sodiu. Tiosărurile sunt distruse sub acțiunea acizilor puternici, eliberând H 2 S gazos și un precipitat de GeS 2 sau SnS 2. Sulfura de plumb(II) nu reacţionează cu polisulfurile, iar sulfura de plumb(IV) este necunoscută.
16.1. Caracteristicile generale ale elementelor grupelor IIIA, IVA și VA
B |
C |
N |
Al Aluminiu |
Si |
P |
Ga |
Ge Germanium |
La fel de |
În |
Sn |
Sb |
Tl |
Pb |
Bi |
Compoziția acestor trei grupe ale sistemului natural de elemente este prezentată în Figura 16.1. Aici sunt date și valorile razelor orbitale ale atomilor (în angstromi). În aceste grupuri, granița dintre elementele care formează metale (raza orbitală mai mare de 1,1 angstromi) și elementele care formează nemetale (raza orbitală mai mică de 1,1 angstromi) este cel mai clar vizibilă. În figură, această margine este prezentată printr-o linie dublă. Nu trebuie să uităm că această limită este încă arbitrară: aluminiul, galiul, staniul, plumbul și antimoniul sunt cu siguranță metale amfotere, dar borul, germaniul și arsenul prezintă și unele semne de amfoteritate.
Dintre atomii elementelor acestor trei grupe, în scoarța terestră se găsesc cel mai adesea următorii: Si (w = 25,8%), Al (w = 7,57%), P (w = 0,090%), C (w = 0,090%). 0,087%) și N (w = 0,030%). Aceștia sunt cei pe care îi veți întâlni în acest capitol.
Formule electronice de valență generale ale atomilor elementelor din grupa IIIA - ns 2 n.p. 1, grup IVA – ns 2 n.p. 2, grupuri VA – ns 2 n.p. 3. Cele mai mari stări de oxidare sunt egale cu numărul grupului. Cele intermediare sunt cu 2 mai puține.
Toate substanțele simple formate din atomii acestor elemente (cu excepția azotului) sunt solide. Multe elemente sunt caracterizate prin alotropie (B, C, Sn, P, As). Există doar trei substanțe moleculare stabile: azot N2, fosfor alb P4 și arsen galben As4.
Elementele nemetalice ale acestor trei grupe tind să formeze compuși moleculari de hidrogen cu legături covalente. În plus, carbonul are atât de multe, încât hidrocarburile și derivații lor sunt studiate de o știință separată - chimia organică. Al doilea cel mai mare număr de compuși cu hidrogen dintre aceste elemente este borul. Borhidrurile (boranele) sunt foarte numeroase și complexe ca structură, astfel încât chimia borohidrurilor a devenit, de asemenea, o ramură separată a chimiei. Siliciul formează doar 8 compuși de hidrogen (silani), azot și fosfor - câte doi, restul - câte un compus de hidrogen. Formule moleculare ale celor mai simpli compuși ai hidrogenului și denumirea lor:
Compoziția oxizilor superiori corespunde celei mai mari stări de oxidare egală cu numărul grupului. Tipul de oxizi superiori din fiecare grup se schimbă treptat odată cu creșterea numărului atomic de la acid la amfoter sau bazic.
Caracterul acido-bazic al hidroxizilor este foarte divers. Deci, HNO3 este un acid puternic, iar TlOH este un alcalin.
1. Realizați formule electronice abreviate și diagrame energetice ale atomilor elementelor grupelor IIIA, IVA și VA. Indicați electronii exteriori și de valență.
Atomul de azot are trei electroni nepereche, deci prin mecanismul de schimb poate forma trei legături covalente. Poate forma o altă legătură covalentă prin mecanismul donor-acceptor, în care atomul de azot capătă o sarcină formală pozitivă de +1 e. Astfel, azotul maxim este pentavalent, dar covalența sa maximă este de patru. (Aceasta explică afirmația des întâlnită că azotul nu poate fi pentavalent).
Aproape tot azotul de pe pământ se găsește în atmosfera planetei noastre. O porțiune semnificativ mai mică de azot este prezentă în litosferă sub formă de nitrați. Azotul face parte din compușii organici conținuți în toate organismele și în produsele descompunerii acestora.
Azotul este singurul simplu molecular substanţă N 2 cu o legătură triplă diatomică în moleculă (Fig. 16.2). Energia acestei legături este de 945 kJ/mol, ceea ce depășește valorile altor energii de legătură (vezi Tabelul 21). Aceasta explică inerția azotului la temperaturi obișnuite. Conform caracteristicilor sale fizice, azotul este un gaz incolor, inodor, familiar de la naștere (trei sferturi din atmosfera pământului este format din azot). Azotul este ușor solubil în apă.

Azotul formează două compuși cu hidrogen: amoniac NH3 și hidrazină N2H6:

Amoniacul este un gaz incolor cu un miros înțepător, sufocant. Inhalarea neglijentă a vaporilor concentrați de amoniac poate provoca spasme și sufocare. Amoniacul este foarte solubil în apă, ceea ce se explică prin formarea a patru legături de hidrogen cu moleculele de apă de către fiecare moleculă de amoniac.

Molecula de amoniac este o particulă de bază (vezi Anexa 14). Acceptând un proton, acesta se transformă într-un ion de amoniu. Reacția poate avea loc atât în soluție apoasă, cât și în fază gazoasă:
NH3 + H2O NH4 + OH (în soluţie);
NH3 + H30B = NH4 + H20 (în soluţie);
NH 3g + HCl g = NH 4 Cl cr (în fază gazoasă).
Soluțiile apoase de amoniac sunt suficient de alcaline pentru a precipita hidroxizii insolubili, dar nu suficient de alcaline pentru ca hidroxizii amfoteri să se dizolve în ele pentru a forma hidroxocomplecși. Prin urmare, soluția de amoniac este convenabilă de utilizat pentru prepararea hidroxizilor amfoteri p-elemente: Al(OH) 3, Be(OH) 2, Pb(OH) 2 etc., de exemplu:
Pb2 + 2NH3 + 2H20 = Pb(OH)2 + 2NH4.
Când este aprins în aer, amoniacul arde pentru a forma azot și apă; atunci când interacționează cu oxigenul în prezența unui catalizator (Pt), acesta este oxidat reversibil la monoxid de azot:
4NH 3 + 3O 2 = 2N 2 + 6H 2 O (fără catalizator),
4NH3 + 5O24NO + 6H2O (cu catalizator).
Când este încălzit, amoniacul poate reduce oxizii metalelor nu foarte active, de exemplu, cuprul:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
Sărurile de amoniu în proprietățile lor (cu excepția stabilității termice) sunt similare sărurilor de metale alcaline. ca și acestea din urmă, aproape toate sunt solubile în apă, dar, deoarece ionul de amoniu este un acid slab, sunt hidrolizați la cation. Când sunt încălzite, sărurile de amoniu se descompun:
NH4CI = NH3 + HCI;
(NH4)2S04 = NH4HS04 + NH3;
(NH4)2C03 = 2NH3 + C02 + H20;
NH4HS = NH3 + H2S;
NH4NO3 = N20 + 2H20;
NH4N02 = N2 + 2H20;
(NH4)2HP04 = NH3 + (NH4)H2P04;
(NH4)H2P04 = NH4P03 + H2O.
Azotul în diferite stări de oxidare formează cinci oxizi: N2O, NO, N2O3, NO2 şi N2O5.
Cel mai stabil dintre ele este dioxidul de azot. Este un gaz otrăvitor maro cu miros neplăcut. Reactioneaza cu apa:
2NO2 + H2O = HNO2 + HNO3.
Cu o soluție alcalină, reacția are loc cu formarea de nitrat și nitriți.
N2O și NO sunt oxizi care nu formează sare.
N 2 O 3 şi N 2 O 5 sunt oxizi acizi. Reacționând cu apa, ele formează soluții de acizi azoți și respectiv acizi azotici.
Oxoacidul de azot în starea de oxidare +III este acidul azot HNO2. Este un acid slab ale cărui molecule există numai în soluție apoasă. Sărurile sale sunt nitriți. Azotul din acidul azot și nitriți este ușor oxidat la starea de oxidare +V.
Spre deosebire de acidul azotic, acidul azotic HNO 3 este un acid puternic. Structura moleculei sale poate fi exprimată în două moduri:
Acidul azotic se amestecă cu apa în toate privințele, reacționând complet cu el în soluții diluate:
HNO3 + H2O = H3O + NO3
Acidul azotic și soluțiile sale sunt agenți oxidanți puternici. Când acidul azotic este diluat, activitatea sa oxidativă scade. În soluțiile de acid azotic de orice concentrație, atomii de oxidare sunt în primul rând atomi de azot, nu hidrogen. Prin urmare, în timpul oxidării diferitelor substanțe cu acid azotic, hidrogenul este eliberat doar ca produs secundar. În funcție de concentrația acidului și de activitatea reducătoare a celuilalt reactiv, produșii de reacție pot fi NO2, NO, N2O, N2 și chiar NH4. Cel mai adesea se formează un amestec de gaze, dar în cazul acidului azotic concentrat se eliberează doar dioxid de azot:
Cu + 4HNO 3 = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
3FeS + 30HNO3 = Fe2(SO4)3 + Fe(NO3)3 + 27NO2 + 15H2O
În cazul acidului azotic diluat, cel mai adesea se eliberează monoxid de azot:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
3H 2 S + 2HNO 3 = 2NO + 4H 2 O + 3S
În cazul acidului azotic foarte diluat care reacționează cu un agent reducător puternic (Mg, Al, Zn), se formează ioni de amoniu:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Acele metale care sunt pasivate de acid sulfuric concentrat sunt, de asemenea, pasivate de acid azotic concentrat.
Sărurile acidului azotic - nitrații - sunt compuși instabili termic. Când sunt încălzite, se descompun:
2KNO3 = 2KNO2 + O2;
2Zn(N03)2 = 2ZnO + 4NO2 + O2;
2AgNO3 = 2Ag + 2NO2 + O2.
1. Scrieți ecuații descriptive pentru reacțiile date în textul paragrafului.
2. Creați ecuații de reacție care caracterizează proprietățile chimice ale a) amoniacului, b) acidului azotic, c) azotatului de zinc.
Proprietățile chimice ale amoniacului și acidului azotic.
16.3. Fosfor
Spre deosebire de atomul de azot, atom fosforul poate forma cinci legături covalente printr-un mecanism de schimb. Explicația tradițională pentru aceasta se rezumă la posibilitatea de excitare a unuia dintre 3 s-electroni și trecerea lor la 3 d-subnivel.
Elementul fosfor se formează destul de mult modificări alotropice. Dintre acestea, trei modificări sunt cele mai stabile: fosfor alb, fosfor roșu și fosfor negru. Fosforul alb este o substanță ceroasă, toxică, predispusă la arderea spontană în aer, constând din molecule P4. Fosforul roșu este o substanță nemoleculară, mai puțin activă, de culoare roșu închis, cu o structură destul de complexă. De obicei, fosforul roșu conține întotdeauna un amestec de alb, astfel încât atât fosforul alb, cât și cel roșu sunt întotdeauna stocați sub un strat de apă. Fosforul negru este, de asemenea, o substanță nemoleculară cu o structură cadru complexă.
Moleculele de fosfor alb sunt tetraedrice, atomul de fosfor din ele este trivalent. Modelul cu bile și baston și formula structurală a moleculei de fosfor alb:
![]()
Structura fosforului roșu poate fi exprimată prin formula structurală:

Fosforul se obține din fosfatul de calciu prin încălzire cu nisip și cocs:
Ca3(P04)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
Fosforul se caracterizează cel mai mult prin compuși cu starea de oxidare +V. Când reacţionează cu excesul de clor, fosforul formează pentaclorură. În timpul arderii oricărei modificări alotrope a fosforului, se formează excesul de oxigen oxid fosfor (V):
4P + 5O2 = 2P2O5.
Există două modificări ale oxidului de fosfor(V): nemoleculară (cu cea mai simplă formulă P 2 O 5) și moleculară (cu formula moleculară P 4 O 10). Oxidul de fosfor este de obicei un amestec al acestor substanțe.

Acest oxid acid foarte higroscopic, reacționând cu apa, formează succesiv acizi metafosforici, difosforici și ortofosforici:
P205 + H20 = 2HP03, 2H203 + H2O = H4P2O7, H4P2O7 + H20 = 2H3PO4.
Ortofosforic acid(numit de obicei simplu fosforic) este un acid slab tribazic (vezi Anexa 13). Este o substanță cristalină incoloră, foarte solubilă în apă. Când reacționează cu baze puternice, în funcție de raportul dintre reactivi, formează trei rânduri săruri(ortofosfați, hidroortofosfați și ortofosfați dihidrogenați - de obicei prefixul „orto” este omis din numele lor):
H3PO4 + OH = H2PO4 + H2O,
H3PO4 + 2OH = HPO42 + 2H2O,
H3P04 + 3OH = PO43 + 3H20.
Majoritatea fosfaților medii (cu excepția sărurilor elementelor alcaline, altele decât litiul) sunt insolubili în apă. Există mult mai mulți fosfați acizi solubili.
Acidul fosforic se obține din fosfatul de calciu natural prin tratarea acestuia cu exces de acid sulfuric. Cu un raport diferit de fosfat de calciu și acid sulfuric, se formează un amestec de fosfat dihidrogen și sulfat de calciu, folosit în agricultură ca îngrășământ mineral numit „superfosfat simplu”:
Ca3(P04)2 + 3H2S04 = 2H3P04 + 3CaS04;
Ca3 (P04)2 + 2H2SO4 = Ca (H2PO4)2 + 2CaS04.
„Superfosfatul dublu” mai valoros se obține prin reacție
Ca3(P04)2 + 4H3PO4 = 3Ca(H2P04)3.
Principala substanță a acestui îngrășământ mineral este fosfatul dihidrogen de calciu.
1. Compuneți ecuații moleculare pentru reacțiile pentru care ecuații ionice sunt date în textul paragrafului.
2. Notează descriptiv ecuațiile pentru reacțiile date în textul paragrafului.
3. Creați ecuații de reacție care caracterizează proprietățile chimice ale a) fosforului, b) oxidului de fosfor (V), c) acidului ortofosforic, d) fosfatului dihidrogen de sodiu.
Proprietățile chimice ale acidului fosforic.
16.4. Carbon
Carbonul este componenta principală a tuturor organismelor. În natură, există atât substanțe simple formate din carbon (diamant, grafit), cât și compuși (dioxid de carbon, diferiți carbonați, metan și alte hidrocarburi din gaze naturale și petrol). Fracția de masă a carbonului din cărbunii tari ajunge la 97%.
Atom carbonul în starea fundamentală poate forma două legături covalente printr-un mecanism de schimb, dar în condiții normale astfel de compuși nu se formează. Când un atom de carbon intră într-o stare excitată, folosește toți cei patru electroni de valență.
Carbonul se formează destul de mult modificări alotropice(vezi Fig. 16.2). Acestea sunt diamante, grafit, carabine și diverse fullerene.

Diamantul este o substanță cristalină foarte tare, incoloră, transparentă. Cristalele de diamant sunt formate din atomi de carbon sp 3-stare hibridizată, formând un cadru spațial.
Grafitul este o substanță cristalină destul de moale de culoare gri-negru. Cristalele de grafit constau din straturi plate în care se află atomii de carbon sp 2-hibrid stau și formează rețele cu celule hexagonale.
Carbyne este o substanță incoloră cu o structură fibroasă, constând din molecule liniare în care atomii de carbon sunt localizați în sp-starea hibridă (=C=C=C=C= sau –C C–C C–).
Fulerenele sunt modificări moleculare alotrope ale carbonului cu molecule C 60, C 80 etc. Moleculele acestor substanțe sunt sfere cu plasă goală.
Toate modificările carbonului prezintă proprietăți reducătoare într-o măsură mai mare decât cele oxidante, de exemplu, cocsul (un produs al prelucrării cărbunelui; conține până la 98% carbon) este utilizat pentru a reduce fierul din minereurile de oxizi și o serie de alte metale din oxizii lor. :
Fe 2 O 3 + 3C = 2Fe + 3CO (la temperatură ridicată).
Majoritatea compușilor de carbon sunt studiați în chimia organică, despre care veți învăța în clasele a 10-a și a 11-a.
În substanțele anorganice, starea de oxidare a carbonului este +II și +IV. Cu aceste stări de oxidare ale carbonului, există două oxid.
Monoxidul de carbon (II) este un gaz otrăvitor, incolor, inodor. Numele banal este monoxid de carbon. Formată în timpul arderii incomplete a combustibilului care conține carbon. Pentru structura electronică a moleculei sale, vezi pagina 121. Conform proprietăților chimice, CO este un oxid care nu formează sare, când este încălzit, prezintă proprietăți reducătoare (reduce mulți oxizi ai metalelor nu foarte active la metal).
Monoxidul de carbon (IV) este un gaz incolor, inodor. Numele banal este dioxid de carbon. Oxid acid. Este ușor solubil în apă (fizic), reacționează parțial cu ea, formând cărbune acid H 2 CO 3 (moleculele acestei substanțe există numai în soluții apoase foarte diluate).
Acidul carbonic este un acid foarte slab (vezi Anexa 13), dibazic, formează două rânduri săruri(carbonați și bicarbonați). Majoritatea carbonaților sunt insolubili în apă. Dintre hidrocarbonați, numai hidrocarbonații de metale alcaline și de amoniu există ca substanțe individuale. Atât ionul carbonat, cât și ionul bicarbonat sunt particule de bază, prin urmare atât carbonații cât și bicarbonații din soluții apoase sunt supuși hidrolizei la anion.
Dintre carbonați, cei mai importanți sunt carbonatul de sodiu Na 2 CO 3 (sodă, sodă, bicarbonat de sodiu), bicarbonatul de sodiu NaHCO 3 (bicarbonat de sodiu, bicarbonat de sodiu), carbonatul de potasiu K 2 CO 3 (potasiu) și carbonatul de calciu CaCO 3 (cretă, marmură, calcar).
Reacție calitativă pentru prezența dioxidului de carbon în amestecul de gaze: formarea unui precipitat de carbonat de calciu la trecerea gazului de testare prin apă de var (o soluție saturată de hidroxid de calciu) și dizolvarea ulterioară a precipitatului la trecerea în continuare a gazului. Reacții care au loc: elementul siliciu formează unul substanță simplă cu acelasi nume. Aceasta este o substanță nemoleculară cu structură de diamant, față de care siliciul este doar puțin inferior ca duritate. În ultima jumătate de secol, siliciul a devenit un material absolut esențial pentru civilizația noastră, deoarece monocristalele sunt folosite în aproape toate echipamentele electronice.
Siliciul este o substanță destul de inertă. la temperatura camerei, nu reacționează practic cu nimic, în afară de fluor și fluorură de hidrogen:
Si + 2F2 = SiF4;
Si + 4HF = SiF4 + 2H2.
Când este încălzită sub formă de pulbere măcinată fin, arde în oxigen, formând dioxid (SiO2). Când se topește cu alcalii sau când este fiert cu soluții concentrate de alcalii, formează silicați:
Si + 4NaOH = Na4SiO4 + 2H2;
Si + 2NaOH + H20 = Na2SiO3 + 2H2.
Monoxid de siliciu SiO – care nu formează sare oxid; se oxidează ușor la dioxid.
Dioxidul de siliciu SiO 2 este o substanță nemoleculară cu o structură cadru. Nu reacționează cu apa. oxid de acid - atunci când este fuzionat cu alcalii, formează silicați, de exemplu:
SiO2 + 2NaOH = Na2SiO3 + H2O. Aluminiul este următorul element cel mai abundent din litosfera Pământului, după siliciu. Singur și împreună cu siliciul, formează multe minerale: feldspați, mica, corindon Al 2 O 3 și soiurile sale prețioase (leucozafir incolor, rubin cu conținut de crom, safir cu conținut de titan).
Substanța simplă aluminiu este un metal ușor strălucitor alb-argintiu. Aluminiul pur este foarte moale, poate fi rulat în folie subțire și sârmă poate fi trasă din ea. Aluminiul are o conductivitate electrică bună. Este rezistent la influențele atmosferice. Aliajele de aluminiu sunt destul de dure, dar pot fi prelucrate bine. Aluminiul nu este otrăvitor. Toate acestea permit utilizarea aluminiului într-o mare varietate de industrii: în aviație, industria electrică, industria alimentară și construcții. Aluminiul este, de asemenea, utilizat pe scară largă în viața de zi cu zi. Aluminiul este produs prin electroliza topiturii compușilor săi.
Inerția chimică a aluminiului este cauzată de prezența unui film dens de oxid pe suprafața sa, care împiedică contactul metalului cu reactivul. Când acest film este îndepărtat chimic sau mecanic, aluminiul devine foarte activ. Astfel, lipsit de o peliculă de oxid, aluminiul se aprinde spontan și arde în aer fără încălzire suplimentară.
Proprietățile reducătoare ale aluminiului sunt deosebit de pronunțate atunci când este încălzit. În aceste condiții, reduce multe metale din oxizi: nu numai fier, titan, zirconiu, ci chiar și calciu și bariu.
Oxidul de aluminiu Al 2 O 3 (denumiri banale - alumină, corindon) este o substanță nemoleculară, legătura în care este slab descrisă atât ca ionică, cât și ca covalentă. Ca întotdeauna în aceste cazuri, este un oxid amfoter. Se obține prin calcinarea hidroxidului de aluminiu, care are și proprietăți amfotere.
Ionul de aluminiu hidratat este un acid cationic, astfel încât sărurile de aluminiu solubile sunt destul de puternic hidrolizate.
Dintre sărurile de aluminiu, cel mai frecvent utilizat este alaunul de potasiu KAl(SO 4) 2 ·12H 2 O - sulfat de potasiu aluminiu dodecahidrat. Este o substanță nehigroscopică, perfect cristalizantă. Soluția sa se comportă ca un amestec de soluții a doi sulfați diferiți: sulfat de potasiu și sulfat de aluminiu. Structura alaunului poate fi exprimată prin formula: (SO 4) 2.
1. Scrieți ecuații descriptive pentru reacțiile date în textul paragrafului.
2. Creați ecuații de reacție care caracterizează proprietățile chimice ale a) aluminiului, b) hidroxidului de aluminiu, i) alaunului de potasiu..
Proprietățile chimice ale sărurilor de aluminiu